
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为________。
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=________。
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:______________。
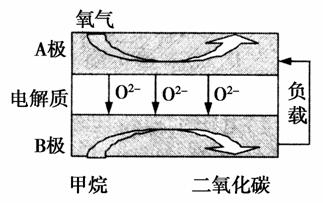
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池________极,电极反应式为________________。
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,写出阳极的电极反应式:_______________,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______(标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为________________。
解析:本题考查了热化学和电化学知识,意在考查考生综合运用所学知识的能力。(1)由“对H2的相对密度为17”可知,平均相对分子质量为34,设NO为x mol,NO2为y mol,则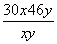 =34,xy=31。即NO为3y mol,16 g CH4为1 mol,转移电子8 mol,由得失电子守恒得4y+6y=8,y=0.8,最后没有NO,则0.2 mol×ΔH2+0.8 mol×ΔH1=-1042.8 kJ,ΔH2=-574 kJ/mol。由(第一个方程式-第二个方程式)÷2得4NO(g)===2NO2(g)+N2(g) ΔH=-293 kJ/mol。(2)由电池工作原理示意图可知。B极通入的是甲烷,为负极,总反应为CH4+2O2===CO2+2H2O,正极反应为2O2+8e-===4O2-,总反应减去正极反应即得负极反应:CH4+4O2--8e-===CO2+2H2O。阳极的电极反应式为2H2O-4e-===O2↑+4H+;阴极首先发生Cu2++2e-===Cu,当Cu2+消耗完毕,H+放电:2H++2e-===H2↑,设生成氢气和氧气都是x mol,则转移电子4x mol,0.2+2x=4x,x=0.1 mol,转移0.4 mol电子消耗甲烷0.05 mol,体积为1.12 L(标准状况下),消耗甲烷体积比理论上大,有可能是甲烷不完全被氧化生成C或CO(或电池能量转化率达不到100%等)。
=34,xy=31。即NO为3y mol,16 g CH4为1 mol,转移电子8 mol,由得失电子守恒得4y+6y=8,y=0.8,最后没有NO,则0.2 mol×ΔH2+0.8 mol×ΔH1=-1042.8 kJ,ΔH2=-574 kJ/mol。由(第一个方程式-第二个方程式)÷2得4NO(g)===2NO2(g)+N2(g) ΔH=-293 kJ/mol。(2)由电池工作原理示意图可知。B极通入的是甲烷,为负极,总反应为CH4+2O2===CO2+2H2O,正极反应为2O2+8e-===4O2-,总反应减去正极反应即得负极反应:CH4+4O2--8e-===CO2+2H2O。阳极的电极反应式为2H2O-4e-===O2↑+4H+;阴极首先发生Cu2++2e-===Cu,当Cu2+消耗完毕,H+放电:2H++2e-===H2↑,设生成氢气和氧气都是x mol,则转移电子4x mol,0.2+2x=4x,x=0.1 mol,转移0.4 mol电子消耗甲烷0.05 mol,体积为1.12 L(标准状况下),消耗甲烷体积比理论上大,有可能是甲烷不完全被氧化生成C或CO(或电池能量转化率达不到100%等)。
答案:(1)①31(2分) ②-574 kJ/mol(2分)
③4NO(g)===2NO2(g)+N2(g) ΔH=-293 kJ/mol(2分)
(2)④负(2分)
CH4+4O2--8e-===CO2+2H2O(2分)
⑤2H2O-4e-===O2↑+4H+(2分) 1.12 L(2分) 甲烷不完全被氧化生成C或CO(或电池能量转化率达不到100%,其他合理答案也可)(2分)


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
下列涉及有机物的说法正确的是( )
A.乙烯和聚乙烯都能发生加聚反应
B.汽油、煤油、柴油和植物油都是碳氢化合物
C.乙烯、苯都可与溴水发生加成反应
D.2己烯能使KMnO4(H+)溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是( )
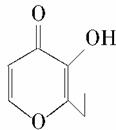
A.该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1 mol该有机物最多能与2 mol H2发生加成反应
D.该有机物的一种芳香族同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-1367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.2NO2===O2+2NO
ΔH=+116.2 kJ·mol-1(反应热)
D.S(s)+O2(g)===SO2(g)
ΔH=-296.8 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
钛被称为“21世纪金属”,是研制卫星、火箭、宇宙飞船及深海潜艇的重要材料。研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置模拟获得金属钙(需定期更换石墨棒),并以钙为还原剂,还原二氧化钛制备金属钛。下列叙述正确的是( )
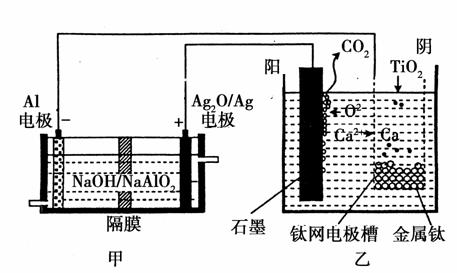
A.甲装置工作过程中OH-向Ag2O/Ag极移动,乙装置工作过程中O2-向阴极移动
B.若电解金属Ti效率为η,则制备1 mol Ti时消耗Al的物质的量为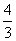 (1-η) mol
(1-η) mol
C.乙装置阳极的电极反应式为C+2O2--4e-===CO2↑
D.在制备金属钛前后,整套装置中CaO的总量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X(g)+Y(g)nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
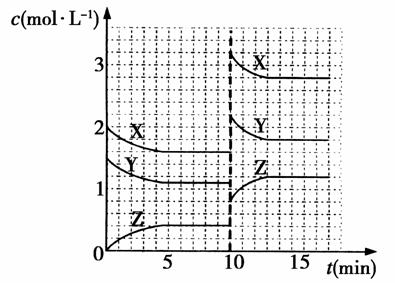
A.反应方程式中n=1
B.10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1 K1=a
(2)2NO(g)+O2(g)2NO2(g)
ΔH2=-144 kJ·mol-1 K2=b
(3)NO2(g)+SO2(g)SO3(g)+NO(g)
ΔH3=-m kJ·mol-1 K3 =c
下列说法正确的是( )
A.m=53 c2=a/b B.m=-26.5 2c=a-b
C.m=-170.5 2c=a-b D.m=26.5 c2=a/b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和原因解释不合理的是( )
| 选项 | 实验操作 | 实验现象 | 原因解释 |
| A | 将一片较薄的铝片放在酒精灯火焰上灼烧 | 铝片慢慢熔化呈液滴状 | 铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低,熔化了 |
| B | 将等表面积的镁条、铝片(均除去氧化膜)分别放入装有等浓度、等体积盐酸的两支试管中 | 都产生气泡,镁条表面产生气泡更快 | 镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快 |
| C | 在打磨过的铁片上先滴一滴饱和食盐水,再滴一滴酚酞 | 液滴的外圈先出现红色 | 铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增 大,溶液呈碱性 |
| D | 取少量淀粉和稀硫酸,加热几分钟,冷却后加入新制氢氧化铜,加热至沸腾 | 未见砖红色沉淀生成 | 淀粉水解后没有葡萄糖生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com