
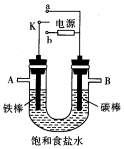
 根据如图装置进行电化学的相关实验,回答下列问题.
根据如图装置进行电化学的相关实验,回答下列问题.分析 (1)若把开关K与a连接,是原电池装置,碳棒作正极,铁棒发生氧化反应,电极反应式为Fe-2e-=Fe2+;
(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
①石墨为阳极,发生氧化反应生成氯气,能使湿润的KI淀粉试纸变蓝,铁为阴极;
②氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)若把开关K与a连接,是原电池装置,碳棒作正极,铁棒发生氧化反应,电极反应式为Fe-2e-=Fe2+,故答案为:正;Fe-2e-=Fe2+;
(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
故答案为:2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
①石墨为阳极,发生氧化反应生成氯气,能使湿润的KI淀粉试纸变蓝,铁为阴极,碳棒上发生的电极反应为2Cl--2e-=Cl2↑,故答案为:正;2Cl--2e-=Cl2↑;
②氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:多选题
| A. | N4和N2是氮元素的两种不同单质 | |
| B. | ${\;}_{7}^{14}{N}_{4}$、${\;}_{7}^{15}{N}_{2}$互为同位素 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | ${\;}_{7}^{14}{N}_{4}$的摩尔质量是56g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
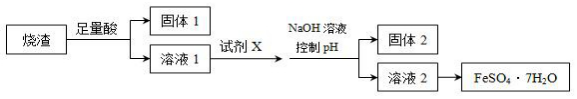
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH为使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | NH4++H2O?NH4OH+H+ | ||
| C. | HCO3-+H2O?CO2↑+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁与0.05mol Cl2充分反应,转移0.1NA电子 | |
| B. | 27g Al与足量NaOH溶液反应生成 33.6L H2 | |
| C. | 1mol由乙烯(C2H4)和乙烷(C2H6)组成的混合物中含有碳原子的数目为2NA | |
| D. | 0.1mol Na2O2与足量二氧化碳反应转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.7 g | B. | 5.85 g | C. | 8 g | D. | 15.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
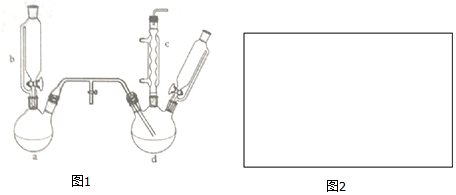
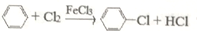 .
.| 项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
| 苯流失量(t/kg) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com