
分析下图所示的四个原电池装置,其中结论正确的是( )
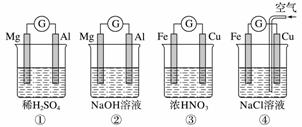
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
科目:高中化学 来源: 题型:
在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为原子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),向所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热条件下还原相同质量的混合物能得到铁的物质的量为( )
A.0.21 mol B.0.24 mol
C.0.16 mol D.0.14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表:
| 实验操作 | 实验现象 |
| Ⅰ.用砂纸打磨后的镁带与沸水反应,再向反应后溶液中滴加酚酞 Ⅱ.向新制的H2S饱和溶液中滴加新制的氯水 Ⅲ.钠与滴有酚酞溶液的冷水反应 Ⅳ.镁带与2 mol·L-1的盐酸反应 Ⅴ.铝条与2 mol·L-1的盐酸反应 Ⅵ.向AlCl3溶液滴加NaOH溶液至过量 | A.浮于水面,熔成一个小球,在水面上无定向 移动,随之消失,溶液变红色 B.产生气体,可在空气中燃烧,溶液变成浅红 色 C.反应不十分强烈,产生的气体可以在空气中 燃烧 D.剧烈反应,产生可燃性气体 E.生成白色胶状沉淀,进而沉淀消失 F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:___________________________________________________。
(2)实验用品:仪器①______________、②____________、③____________、④试管夹、⑤镊子、⑥小刀、⑦玻璃片、⑧砂纸、⑨胶头滴管等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、新制的饱和H2S溶液、AlCl3溶液、NaOH溶液等。
(3)请你写出上述的实验操作与对应的现象
Ⅰ________、Ⅱ________、Ⅲ________、Ⅳ________、Ⅴ________、Ⅵ________。(用A~F表示)
写出实验操作Ⅱ、Ⅵ的离子反应方程式
实验Ⅱ________________________________________________________________________;
实验Ⅵ________________________________________________________________________。
(4)实验结论:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_________________。
(2)用该方法获得的Na2S2O3·H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】 假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:________________________________________________________________________。
【查阅资料】 Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
【判断与思考】 某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?________(填“合理”或“不合理”)并说明理由:_________________________________________。
【设计方案进行实验】 基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2===2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是( )
A.A>B>C>D>E B.A>C>D>B>E
C.C>A>B>D>E D.B>D>C>A>E
查看答案和解析>>
科目:高中化学 来源: 题型:
铝-空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
电池总反应为4Al+3O2+6H2O===4Al(OH)3
负极:________________________________________________________________________;
正极:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH—Ni电池)。下列有关说法不正确的是( )
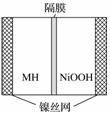
A.放电时正极反应为NiOOH+H2O+e-—→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为MH+OH-—→H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com