
反应时间t/h | 1 | 4 | 9 | 16 | 25 |
MgO层厚Y/nm | |||||
NiO层厚Y′/nm | B | 2b | 3b | 4b | 5b |
注:a和b均为与温度有关的常数。
(1)金属高温氧化腐蚀速率可用金属氧化膜的生长速率来表示,其理由是_________________。
(2)金属氧化膜的膜厚Y和Y′跟时间t所呈现的关系是_______________,_______________;MgO氧化膜膜厚Y属_______________型,NiO氧化膜膜厚Y′属_______________型(填“直线”“抛物线”“对数”或“双曲线”等类型)。
(3)Mg与Ni相比较,金属_______________具有更良好的耐高温氧化腐蚀性,其理由是_____________________________________________________________________。
解析:本题考查我们获取、分析和处理图表信息的能力及应用数学工具解决化学问题的能力,考查了学生的综合素质。(1)金属因高温被氧化而遭到破坏是常见的一种腐蚀现象。不同的金属因其形成的氧化膜质密程度不同,它们的耐腐蚀性亦不同。化学反应的快慢既可由反应物的消耗速率表示,也可由生成物的生成速率来表示,显然,金属的腐蚀速率可用其氧化膜的生长速率表示。(2)根据题给数据不难导出以下数学关系式:MgO膜厚Y与时间t的关系为Y=0.05t;NiO膜厚Y′与时间t的关系为Y′=bt1/2。由数学知识知,前者为直线型,后者为抛物线型。(3)据(2)可知Y′随时间t增长要比Y随时间t增长得慢,故而镍的耐高温氧化腐蚀性要比镁的好。
答案:(1)化学反应的快慢既可用反应物的消耗速率表示,也可用生成物的生成速率来表示,显然,金属的腐蚀速率可用其氧化膜的生长速率表示
(2)MgO膜厚Y与时间t的关系为Y=0.05t NiO膜厚Y′与时间t的关系为Y′=bt1/2 直线 抛物线
(3)Ni Y′随时间t增长要比Y随时间t增长得慢


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
| 温度 | 25℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)CH3OH(g) △H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H1 0(填“>”、
“=”或“<”)。
| 温度 | 25℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门市高二下学期质量检测化学试题 题型:填空题
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)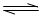 CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H1 0(填“>”、
“=”或“<”)。
|
温度 |
25℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H1 0(填“>”、
“=”或“<”)。
| 温度 | 25℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com