
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
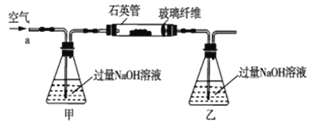
(实验一)测定硫元素的含量
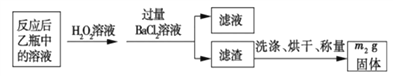
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
【答案】 提供反应物O2,排尽生成的SO2,使之完全被乙瓶溶液吸收 Na2SO3+H2O2=Na2SO4+H2O H2O2![]() H++HO2-
H++HO2- ![]() ×100% (或
×100% (或![]() ×100%等其他合理答案) 偏大 (沿玻璃棒)向过滤器中加入蒸馏水至浸没固体。(静置)待水自然全部留下,重复操作2~3次 0.5000mol·L-1
×100%等其他合理答案) 偏大 (沿玻璃棒)向过滤器中加入蒸馏水至浸没固体。(静置)待水自然全部留下,重复操作2~3次 0.5000mol·L-1
【解析】(1)鼓入空气的作用显然是提供氧气,并且将生成的SO2完全吹出,使之完全被乙中的氢氧化钠吸收;(2)为减少实验误差,最后使SO32-完全转化成SO42-,从而生成硫酸钡沉淀,双氧水足量时才能将亚硫酸根离子完全转化,反应为Na2SO3+H2O2=Na2SO4+H2O;H2O2是弱酸,电离方程式是H2O2![]() H++HO2-;(3)亚硫酸钠被氧化生成硫酸钠,硫酸根离子和钡离子反应生成白色沉淀硫酸钡,n(BaSO4)=m2g/223g·mol-1=m2/233mol,根据S原子守恒得n(S)=n(BaSO4)=m2/233mol,S元素质量分数=
H++HO2-;(3)亚硫酸钠被氧化生成硫酸钠,硫酸根离子和钡离子反应生成白色沉淀硫酸钡,n(BaSO4)=m2g/223g·mol-1=m2/233mol,根据S原子守恒得n(S)=n(BaSO4)=m2/233mol,S元素质量分数=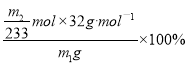 =
=![]() ;(4)步骤②中,若用铁粉作还原剂,铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大;(5)请写出步骤②中洗涤的方法:(沿玻璃棒)向过滤器中加蒸馏水至浸没固体,(静置)待水自然全部流下,重复操作2~3次;(6)依据实验流程,Fe2+被高锰酸钾溶液滴定发生氧化还原反应,高锰酸钾溶液平均消耗体积=
;(4)步骤②中,若用铁粉作还原剂,铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大;(5)请写出步骤②中洗涤的方法:(沿玻璃棒)向过滤器中加蒸馏水至浸没固体,(静置)待水自然全部流下,重复操作2~3次;(6)依据实验流程,Fe2+被高锰酸钾溶液滴定发生氧化还原反应,高锰酸钾溶液平均消耗体积=![]() mL=25.00mL(其中20.00ml的数值与其他数据相差较大,舍去);设亚铁离子物质的量为x,依据方程式得到:
mL=25.00mL(其中20.00ml的数值与其他数据相差较大,舍去);设亚铁离子物质的量为x,依据方程式得到:
5 Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
x 0.1mol·L-1×0.025L
x=0.0125mol;
c(Fe2+)=0.0125mol/0.025L=0.5000mol·L-1。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】下列说法完全正确的是( )
A.放热反应均是自发反应
B.如果ΔH和ΔS 均为正值,当温度升高时,反应可能自发进行
C.ΔS为正值的反应均是自发反应
D.物质的量增加的反应,ΔS为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。比如:

(1)上图所示的物质分类方法名称是 ;
(2)按上述分类法,下列物质中Fe、O2、H2SO4、Ba(OH)2、Ca(HCO3)2、SO2属于酸的是__________,这些物质间有的可发生化学反应,请写出一个属于置换反应的离子方程式:___________________;
人们利用分类法对化学物质和化学反应进行分类学习,例如CO2属于二元弱酸的酸性氧化物,Ca(OH)2属于强碱,已知将过量CO2缓缓通入澄清石灰水中,溶液先变浑浊,后又变澄清;NaOH也属于强碱,请写出:
少量CO2与NaOH溶液反应的离子方程式:____________________________;
过量CO2与NaOH溶液反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
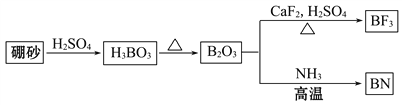
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、__________________________。
(2)基态B原子的电子排布式为________,B和N相比,电负性较大的是________,BN中B元素的化合价为________。
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为________。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是
A. 用焰色反应鉴別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分离食醋中的乙酸与水
C. 用结晶的方法分离氯化钠和硝酸钾的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机花儿会务X(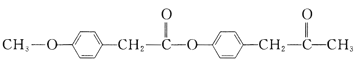 )是有机精细化工的重要中间体,实验室中以M(
)是有机精细化工的重要中间体,实验室中以M(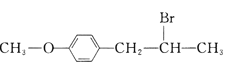 )为原料合成X的路线如下:
)为原料合成X的路线如下:
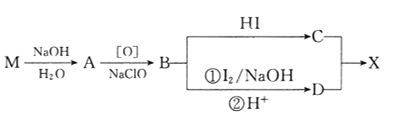

回答下列问题:
(1)B的核磁共振氢谱上有________组峰。
(2)D分子中含有的官能团有_________________________。(填名称)
(3)下列常见含钠试剂能与C反应的有______________。(填标号)
a.氯化钠 b.氢氧化钠 c.纯碱 d.碳酸氢钠
(4)由B转化为C的化学方程式为______________________________,该反应的反应类型是_______________________。
(5)E是D的同分异构体,在苯环的对位上各有一个取代基,能够发生银镜反应和水解反应,1molE与足量钠反应可生成0.5molH2,则E可能的结构有_____种。
(6)有机物F(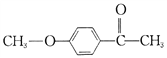 )也是一种重要的有机精细化工中间体,写出由
)也是一种重要的有机精细化工中间体,写出由 ![]() 制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:
制备F的合成路线。(其他试剂任选;已知马氏规则:在不对称烯烃的加成反应中,氢原子总是加在含氢较多的碳原子上。如:![]() )_________________.
)_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
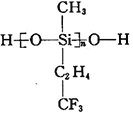
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(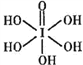 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)
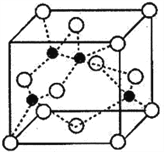
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com