
一个电池的总反应:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是
A. B. C. D.
正极 Zn Cu Cu Ag
负极 Cu Zn Zn Cu
电解质溶液 CuCl2 H2SO4 CuSO4 AgNO3
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。
(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二下学期第一次月考化学试卷 题型:填空题
(16分)下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
2K2CO3+6H2O
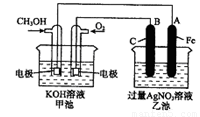
(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 ,
(4)乙池中反应的化学方程式为 。[来源:Z&xx&k.Com]
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
I.光伏组件采用高效率单晶硅或多晶硅光伏电池、高透光率钢化玻璃、抗腐蚀铝合多边框等材料,使用先进的真空层压工艺及脉冲焊接工艺制造。
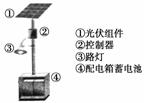 (1)下图是太阳能电池板经太阳光照射前后内部电子的变化情况,图乙中灯泡变亮,其中____(填写“N”或“P”)是正极。
(1)下图是太阳能电池板经太阳光照射前后内部电子的变化情况,图乙中灯泡变亮,其中____(填写“N”或“P”)是正极。
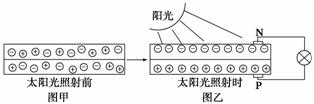
![]() (2)右上图是一个太阳能路灯,图中的④是蓄电池。镍氢电池就是这样一种与太阳能电池配套使用的蓄电池,白天用于充电,夜间供电。这种蓄电池容量大,充电放电循环寿命也较长。该蓄电池的总反应为Ni(OH)2 NiOOH+1/2H2↑。镍氢电池的电解液采用30%的KOH溶液,白天充电反应时的阳极反应式为 ,夜间放电时,负极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(2)右上图是一个太阳能路灯,图中的④是蓄电池。镍氢电池就是这样一种与太阳能电池配套使用的蓄电池,白天用于充电,夜间供电。这种蓄电池容量大,充电放电循环寿命也较长。该蓄电池的总反应为Ni(OH)2 NiOOH+1/2H2↑。镍氢电池的电解液采用30%的KOH溶液,白天充电反应时的阳极反应式为 ,夜间放电时,负极附近溶液的pH________(填“增大”、“减小”或“不变”)。
 II.X、Y、Z、Q、R5种短周期元素原子序数依次增大。化合物甲由X、Z、Q3种元素组成,常温下,0.1mol·L-l甲溶液的pH =13。工业上常用电解QR饱和溶液生产甲
II.X、Y、Z、Q、R5种短周期元素原子序数依次增大。化合物甲由X、Z、Q3种元素组成,常温下,0.1mol·L-l甲溶液的pH =13。工业上常用电解QR饱和溶液生产甲
(3)Q的原子结构示意图为
(4)常温下将R的单质通人甲溶液中,发生反应的离子方程式为
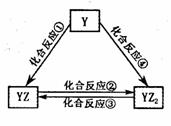
(5)若Y元素的单质能发生如右图所示转化,则Y元素是 。
已知:298K时,反应②生成1mol YZ2(g)时放出热量283.O kJ·mol-1,
反应④生成1mol YZ2(g)时放出热量393.5 kJ·mol-1,反应③的热化学方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com