
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
 A.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶
A.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶
液变浑浊
B.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中
先产生白色沉淀后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
科目:高中化学 来源: 题型:
下列关于Na2O和Na2O2的叙述正确的是( )
A.Na2O与Na2O2颜色相同 B.均可与CO2、H2O反应产生氧气
C.所含氧元素的化合价均为-2 D.阴阳离子的个数比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是:( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,消除氮氧化物污染有多种方法。
⑴用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g) ΔH=-574 kJ·mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
⑵用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变 B.v正(N2)=2 v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为 (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______。
⑶合成塔失去活性的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:
Zn(s) +2MnO2 (s) +H2O(l) = Zn(OH)2 (s) +Mn2O3(s) ,该电池正极的电极反应式是
。PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是; 若电解液中不加入Cu(NO3)2这样做的主要缺点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.只有② B.①②③ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:
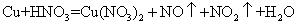 (未配平)
(未配平)
①硝酸在该反应中的作用是__________________,
②19.2g Cu被硝酸完全溶解后,若得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是__________________。
(2)①已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + === HCl + H3PO4
配平上述反应方程式,并表示电子转移的方向和数目。
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O === 20Cu3P + 24 H3PO4 + 60 H2SO4
在该反应中30molCuSO4可氧化P4的物质的量是 。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下它能使工业废气中的氮的氧化物、SO2等分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe2O4)经高温还原制得。转化流程如图所示:
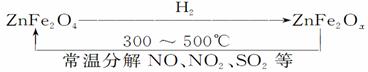
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x=________。写出铁酸锌高温被H2还原生成氧缺位铁酸锌的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明醋酸是弱电解质的事实是()
A. 醋酸水溶液能使湿润的蓝色石蕊试纸变红
B. 醋酸和碳酸钠溶液反应放出二氧化碳
C. c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大
D. 浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com