
| A. | 2Al(s)+2NaOH(aq)+2H2O(1)═2NaAlO2(aq)+3H2(g);△H<O | |
| B. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq)+8H2O(1);△H>0 | |
| C. | C3H8(g)+5O2(g)→4H2O (l)+3CO2(g);△H<0 | |
| D. | FeCl3(aq)十3H2O(1)?Fe(OH)3(s)+3HCl(aq);△H>0 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
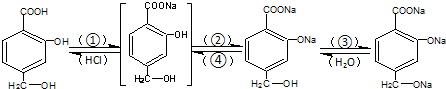
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
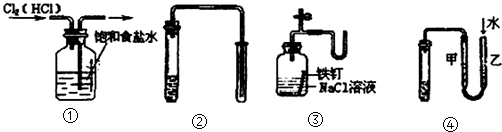
| A. | ①②③④ | B. | ③④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素X的最高价氧化物对应水化物一定是强碱 | |
| C. | 元素Y是ⅢA族的元素 | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 任何物质所含的分子数均为NA个 | |
| B. | 14 g氮气所含的N原子数为NA个 | |
| C. | 标准状况下,22.4 L水所含的H2O分子数为NA个 | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中只生成氧化物 | |
| C. | 制备FeCl3不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3溶液是阴极上析出Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
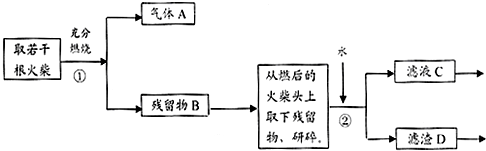
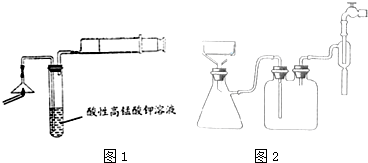
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+.
NH3•H2O+H+. 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com