
”¾ĢāÄæ”æŅŃÖŖæÉÄę·“Ó¦£ŗM£Øg£©+N£Øg£©P£Øg£©+Q£Øg£© H£¾0£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŚÄ³ĪĀ¶ČĻĀ£¬·“Ó¦ĪļĘšŹ¼ÅØ¶Č·Ö±šĪŖ£ŗc£ØM£©=1molL©1 £¬ c£ØN£©=2.4molL©1 £¬ “ļµ½Ę½ŗāŗó£¬MµÄ×Ŗ»ÆĀŹĪŖ60%£¬“ĖŹ±NµÄ×Ŗ»ÆĀŹĪŖ
£Ø2£©Čō·“Ó¦ĪĀ¶ČÉżøߣ¬×Ŗ»ÆĀŹ£ØĢī”°Ōö“ó”±”¢”°¼õÉŁ”±»ņ”°²»±ä”±£©£®
£Ø3£©Čō·“Ó¦ĪĀ¶Č²»±ä£¬·“Ó¦ĪļµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖ£ŗc£ØM£©=4molL©1 £¬ c£ØN£©=a molL©1£»“ļµ½Ę½ŗāŗó£¬c£ØP£©=2molL©1 £¬ a= £®
£Ø4£©Čō·“Ó¦ĪĀ¶Č²»±ä£¬·“Ó¦ĪļµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖ£ŗc£ØM£©=1molL©1 £¬ c£ØN£©=0.3molL©1£»“ļµ½Ę½ŗāŗó£¬MµÄ×Ŗ»ÆĀŹĪŖ £®
”¾“š°ø”æ
£Ø1£©25%
£Ø2£©Ōö“ó
£Ø3£©6
£Ø4£©20%
”¾½āĪö”æ½ā£ŗ£Ø1£©”÷c£ØM£©=60%”Į1molL©1=0.6molL©1 £¬ ÅØ¶Č±ä»ÆĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌ”÷c£ØN£©=”÷c£ØM£©=0.6molL©1 £¬ ¹Ź“ĖŹ±NµÄ×Ŗ»ÆĀŹ ![]() ”Į100%=25%£¬ĖłŅŌ“š°øŹĒ£ŗ25%£»£Ø2£©øĆ·“Ó¦Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņĪüČČ·½ĻņŅĘ¶Æ£¬¼“ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬MµÄ×Ŗ»ÆĀŹŌö“ó£¬
”Į100%=25%£¬ĖłŅŌ“š°øŹĒ£ŗ25%£»£Ø2£©øĆ·“Ó¦Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņĪüČČ·½ĻņŅĘ¶Æ£¬¼“ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬MµÄ×Ŗ»ÆĀŹŌö“ó£¬
ĖłŅŌ“š°øŹĒ£ŗŌö“󣻣Ø3£©
”÷c£ØM£©=60%”Į1molL©1=0.6molL©1 £¬ Ōņ£ŗ
M£Øg£©+ | N£Øg£© | P£Øg£©+ | Q£Øg£© | ||
³õŹ¼£Ømol/L£©£ŗ | 1 | 2.4 | 0 | 0 | |
×Ŗ»Æ£Ømol/L£©£ŗ | 0.6 | 0.6 | 0.6 | 0.6 | |
Ę½ŗā£Ømol/L£©£ŗ | 0.4 | 1.8 | 0.6 | 0.6 |
¹ŹøĆĪĀ¶ČĻĀĘ½ŗā³£Źżk= ![]() =0.5£¬
=0.5£¬
·“Ó¦ĪĀ¶Č²»±ä£¬·“Ó¦ĪļµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖc£ØM£©=4molL©1 £¬ c£ØN£©=amolL©1£»“ļµ½Ę½ŗāŗó£¬c£ØP£©=2molL©1 £¬ Ōņ£ŗ
M£Øg£©+ | N£Øg£© | P£Øg£©+ | Q£Øg£© | ||
³õŹ¼£Ømol/L£©£ŗ | 4 | a | 0 | 0 | |
×Ŗ»Æ£Ømol/L£©£ŗ | 2 | 2 | 2 | 2 | |
Ę½ŗā£Ømol/L£©£ŗ | 2 | a-2 | 2 | 2 |
ĖłŅŌ ![]() =0.5£¬½āµĆa=6£¬
=0.5£¬½āµĆa=6£¬
ĖłŅŌ“š°øŹĒ£ŗ6£»£Ø4£©ÉčMµÄ×Ŗ»ÆĀŹĪŖx£¬ŅĄ¾Ż»Æѧȿ¶ĪŹ½ĮŠŹ½¼ĘĖć
M£Øg£©+ | N£Øg£© | P£Øg£©+ | Q£Øg£© | ||
³õŹ¼£Ømol/L£©£ŗ | 1 | 0.3 | 0 | 0 | |
×Ŗ»Æ£Ømol/L£©£ŗ | x | x | x | x | |
Ę½ŗā£Ømol/L£©£ŗ | 1©x | 0.3©x | x | x |
Ōņ“ļµ½Ę½ŗāŗóø÷ĪļÖŹµÄĘ½ŗāÅØ¶Č·Ö±šĪŖ£ŗ
c£ØM£©=£Ø1©x£©mol/L ””c£ØN£©=£Ø0.3©x£©mol/L
c£ØP£©=x mol/L””c£ØQ£©=x mol/L
K= ![]()
= ![]() =0.5£»
=0.5£»
x=0.20£»
ĖłŅŌ“š°øŹĒ£ŗ20%£®
”¾æ¼µć¾«Īö”æ½ā“š“ĖĢāµÄ¹Ų¼üŌŚÓŚĄķ½ā»ÆŃ§Ę½ŗāדĢ¬±¾ÖŹ¼°ĢŲÕ÷µÄĻą¹ŲÖŖŹ¶£¬ÕĘĪÕ»ÆŃ§Ę½ŗāדĢ¬µÄĢŲÕ÷£ŗ”°µČ”±¼“ VÕż=VÄę>0£»”°¶Æ”±¼“ŹĒ¶ÆĢ¬Ę½ŗā£¬Ę½ŗāŹ±·“Ó¦ČŌŌŚ½ųŠŠ£»”°¶Ø”±¼“·“Ó¦»ģŗĻĪļÖŠø÷×é·Ö°Ł·Öŗ¬Įæ²»±ä£»”°±ä”±¼“Ģõ¼žøÄ±ä£¬Ę½ŗā±»“ņĘĘ£¬²¢ŌŚŠĀµÄĢõ¼žĻĀ½ØĮ¢ŠĀµÄ»ÆŃ§Ę½ŗā£»ÓėĶ¾¾¶ĪŽ¹Ų£¬Ķā½ēĢõ¼ž²»±ä£¬æÉÄę·“Ó¦ĪŽĀŪŹĒ“ÓÕż·“Ó¦æŖŹ¼£¬»¹ŹĒ“ÓÄę·“Ó¦æŖŹ¼£¬¶¼æɽØĮ¢Ķ¬Ņ»Ę½ŗāדĢ¬£ØµČŠ§£©£¬ŅŌ¼°¶Ō»ÆŃ§Ę½ŗāµÄ¼ĘĖćµÄĄķ½ā£¬ĮĖ½ā·“Ó¦Īļ×Ŗ»ÆĀŹ=×Ŗ»ÆÅØ¶Č”ĀĘšŹ¼ÅØ¶Č”Į100%=×Ŗ»ÆĪļÖŹµÄĮæ”ĀĘšŹ¼ĪļÖŹµÄĮæ”Į100%£»²śĘ·µÄ²śĀŹ=Źµ¼ŹÉś³É²śĪļµÄĪļÖŹµÄĮæ”ĀĄķĀŪÉĻæɵƵ½²śĪļµÄĪļÖŹµÄĮæ”Į100%£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÅØ¶Č¾łĪŖ0.1 mol/LµÄĻĀĮŠĪļÖŹµÄČÜŅŗÖŠ£¬c(Cl£)×ī“óµÄŹĒ( )
A. FeCl3B. CuCl2C. KClD. NaClO
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹĒÕŖȔѧɜŹµŃé±Øø굄֊µÄÓļ¾ä£¬ĘäÖŠĖµ·ØÕżČ·µÄŹĒ( )
A.ČÕ³£Éś»īÖŠ²»ÄÜÓĆÖąĢĄ¼ģŃéµāŃĪÖŠŹĒ·ńŗ¬ÓŠKIO3
B.½«ĢśŠ¼”¢ÅØäåĖ®”¢±½»ģŗĻæÉÖʵĆäå±½
C.ÓĆÕōĮ󷽷سżČ„ŅŅ“¼ÖŠµÄĖ®
D.Ļ“µÓ³ĮµķŹ±£¬Ó¦ÓĆ²£Į§°ōĒįĒį½Į°č£¬Ź¹µĆ³Įµķ±ķĆęÉĻµÄŌÓÖŹČÜÓŚĖ®ÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲŹµŃéµÄŠšŹöÖŠÕżČ·µÄŹĒ(””””)
A.ĻņäåĖ®ŗĶµāĖ®ÖŠ·Ö±š¼ÓČėÉŁĮæCCl4,Õńµ“ŗó¾²ÖĆ,ĻĀ²ćµÄŃÕÉ«¶¼±ČÉĻ²ćÉī
B.ÓĆ¹żĮæµÄNaOHČÜŅŗ³żČ„FeCl2ČÜŅŗÖŠµÄFeCl3
C.ÓĆĶŠÅĢĢģĘ½×¼Č·³ĘČ”0.400 0 gŹ³ŃĪ,Åä³É500 mLÅضČĪŖ0.020 0 mol”¤L-1µÄŹ³ŃĪĖ®
D.ijĘųĢåÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ«,ŌņøĆĘųĢåŅ»¶ØŹĒSO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖA”«GÓŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ¹ŲĻµ£Ø²æ·ÖÉś³ÉĪļŅŃĀŌČ„£©£¬ĘäÖŠA”¢GĪŖµ„ÖŹ£¬DŹĒÄÜŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶É«µÄĘųĢ壬E”¢F¾łÄÜÓėNaOHČÜŅŗ·“Ó¦£®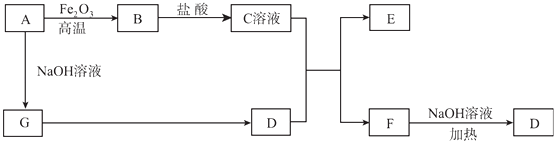
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öFµÄµē×ÓŹ½£ŗ£»
£Ø2£©¢ŁCČÜŅŗÓėDµÄĖ®ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£»¢ŚFČÜŅŗÓėNaOHČÜŅŗ¹²ČČ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£»
£Ø3£©¢ŁĒėÓĆĄė×Ó·½³ĢŹ½½āŹĶCČÜŅŗĪŖŗĪĻŌĖįŠŌ£»¢ŚFČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ£»
£Ø4£©½«5.4 g AĶ¶Čėµ½200 mL 2.0 mol/LijČÜŅŗÖŠÓŠGµ„ÖŹ²śÉś£¬ĒŅ³ä·Ö·“Ó¦ŗóÓŠ½šŹōŹ£Óą£¬ŌņøĆČÜŅŗæÉÄÜŹĒ£ØĢī“śŗÅ£©£»
A.HNO3ČÜŅŗ
B.H2SO4ČÜŅŗ
C.NaOHČÜŅŗ
D.HClČÜŅŗ
£Ø5£©½«1mol N2ŗĶ3mol G¼°“߻ƼĮ³äČėČŻ»żĪŖ2 LµÄijĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£¬ŅŃÖŖøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£®Ę½ŗāŹ±£¬²āµĆDµÄĪļÖŹµÄĮæÅضČĪŖa mol/L£®ŌŚĘäĖūĢõ¼ž²»±äµÄĒéæöĻĀ£¬ČōĘšŹ¼Ź±³äČė0.5 mol N2ŗĶ1.5mol G“ļµ½Ę½ŗāŗó£¬DµÄĪļÖŹµÄĮæÅØ¶Č£ØĢī”°“óÓŚ”±”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©a/2mol/L£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ł“×Ėį¼ÓĖ®Čܽā²¢²»¶ĻĻ”ŹĶ¹ż³ĢÖŠ£¬ČÜŅŗµ¼µēÄÜĮ¦Óė¼ÓČėĖ®µÄĢå»żÓŠČēĶ¼±ä»Æ¹ŲĻµ£ŗ 
£Ø1£©”°0”±µćµ¼µēÄÜĮ¦ĪŖ0µÄĄķÓÉŹĒ£ŗ
£Ø2£©a”¢b”¢cČżµćÖŠµēĄė³Ģ¶Č×ī“óµÄŹĒ£»µēĄėĘ½ŗā³£ŹżµÄ¹ŲĻµŹĒ £® £ØĢī”°Öš½„Ōö“ó”±”¢”°Öš½„¼õŠ””±»ņ”°²»±ä”±µČ£©
£Ø3£©ČōŅŖŹ¹cµćČÜŅŗÖŠc£ØCH3COO©£©”¢c£ØH+£©¾łŌö“ó£¬æɲÉČ”µÄ“ėŹ©ŹĒ£ØČĪĢīŅ»ÖÖŗĻĄķµÄ“ėŹ©¼“æÉ£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ŌŚ±ź×¼×“æöĻĀ£¬½«³äĀśNO2µÄŹŌ¹Üµ¹æŪµ½Ź¢Ė®µÄĖ®²ŪÖŠ£¬Ņ»¶ĪŹ±¼äŗó£¬ŹŌ¹ÜÄŚĘųĢåµÄĢå»żŹĒŹŌ¹ÜĢå»żµÄ________________£¬¼ŁÉčŹŌ¹ÜÄŚČÜÖŹ²»Ą©É¢£¬ŌņŹŌ¹ÜÄŚČÜŅŗÖŠČÜÖŹµÄĪļÖŹµÄĮæÅضČĪŖ___________________”£
£Ø2£©Ä³ĢśµÄ”°Ńõ»ÆĪļ”±ŃłĘ·£¬ÓĆ5mol/LµÄŃĪĖį100mLĒ”ŗĆĶźČ«Čܽā£¬ĖłµĆČÜŅŗ»¹ÄÜĪüŹÕ±ź×¼×“æöĻĀ1.12LĀČĘų£¬Ź¹ĘäÖŠFe2+Ē”ŗĆČ«²æ×Ŗ»ÆĪŖFe3+£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_________£¬øĆѳʷ֊FeŗĶOµÄøöŹż±ČĪŖ_______________”£
£Ø3£©ĻņŹ¢ÓŠ10mL1mol/LNH4Al(SO4)2ČÜŅŗµÄÉÕ±ÖŠµĪ¼Ó1mol/LNaOHČÜŅŗ£¬³ĮµķĪļÖŹµÄĮæĖęNaOHČÜŅŗĢå»ż±ä»ÆŹ¾ŅāĶ¼ČēĻĀ£ŗ(ŅŃÖŖNH4++OH-=NH3”¤H2O)
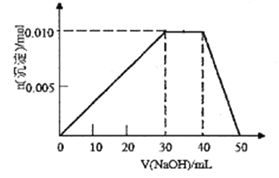
¢ŁŠ“³öµĪ¼ÓNaOHČÜŅŗ40”«50mLŹ±·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ__________________”£
¢ŚČō10mL1mol/LNH4Al(SO4)2ČÜŅŗÖŠøļÓ20mL1.15mol/LBa(OH)2ČÜŅŗ£¬³ä·Ö·“Ó¦ŗó£¬ČÜŅŗÖŠ²śÉś³ĮµķµÄĪļÖŹµÄĮæĪŖ_________________mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij¹ĢĢå»ģŗĻĪļæÉÄÜŗ¬Al”¢£ØNH4£©2SO4”¢MgCl2”¢AlCl3”¢FeCl3ÖŠµÄŅ»ÖÖ»ņ¼øÖÖ£¬ĻÖ¶ŌøĆ»ģŗĻĪļ×÷ČēĻĀŹµŃ飬ĖłµĆĻÖĻóŗĶÓŠ¹ŲŹż¾ŻČēĻĀĶ¼£ØĘųĢåĢå»żŅŃ»»Ėć³É±ź×¼×“æöĻĀµÄĢå»ż£©£®ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø £©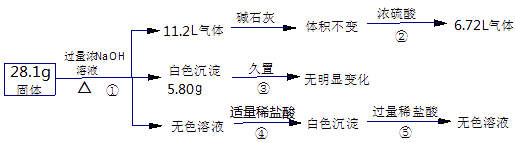
A.øĆŹµŃéµÄÕūøö¹ż³Ģ¹²Éę¼°6øö»Æѧ·“Ó¦
B.øĆŹµŃéµÄÕūøö¹ż³ĢÖ»Éę¼°1øöŃõ»Æ»¹Ō·“Ó¦
C.»ģŗĻĪļÖŠŅ»¶ØÓŠAl”¢£ØNH4£©2SO4”¢MgCl2 £¬ Ņ»¶ØƻӊAlCl3”¢FeCl3
D.»ģŗĻĪļÖŠŅ»¶ØÓŠAl”¢£ØNH4£©2SO4”¢MgCl2”¢AlCl3 £¬ Ņ»¶ØƻӊFeCl3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪŽÉ«»ģŗĻĘųĢåæÉÄÜÓÉCH4”¢H2”¢CO”¢CO2ŗĶHClÖŠµÄij¼øÖÖĘųĢå×é³É”£ŌŚŗćĪĀŗćŃ¹Ģõ¼žĻĀ£¬Ķعż¹żĮæµÄ³ĪĒåŹÆ»ŅĖ®Ī“¼ū±ä»ė×Ē£¬µ«»ģŗĻĘųĢåµÄ×ÜĢå»ż¼õŠ”£»°ŃŹ£ÓąĘųĢåµ¼³öŗó£¬ŌŚO2ÖŠÄܹ»µćČ¼£¬Č¼ÉÕ²śĪļ²»ÄÜŹ¹CuSO4·ŪÄ©±äÉ«”£ŌņŌ»ģŗĻĘųĢåµÄ³É·ŻŹĒ
A. HClŗĶCO B. HCl”¢H2ŗĶCO C. CH4ŗĶNH3 D. HCl”¢COŗĶCO2
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com