
| A、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| B、硫化钠水解:S2-+2H2O?H2S+2OH- |
| C、稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,关于它的下列说法正确的是
,关于它的下列说法正确的是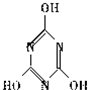 ).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是
).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是查看答案和解析>>
科目:高中化学 来源: 题型:
 A~F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如图所示:
A~F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、④②③① | B、④③②① |
| C、④③①② | D、④①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | |
| A | 已知[Cu(H2O)4]2+(蓝)+4Cl-[CuCl4]2-(绿)+4H2O,蒸发浓缩能使绿色CuCl2溶液向蓝色转化 | 0.1mol?L-的氯化铵溶液与0.05mol?L-的氢氧化钠溶液等体积混合后,混合溶液中离子浓度: c(Cl-)>c(NH4+)>c(Na+)>c(OH-) |
| B | 0.1mol?L-1硫化钠溶液中离子浓度关系: c(Na+)=c(S2-)+c(HS-)+c(H2S) |
冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小 |
| C | 为了提高KMnO4溶液的氧化能力,用盐酸将其酸化 | 升高温度能加快反应速率的主要原因,是增加了反应物分子中活化分子的百分数 |
| D | 常温下醋酸分子可能存在于pH>7的碱性溶液中 | 要制得较纯的FeS沉淀,在FeCl2溶液中加入的试剂可以是Na2S或(NH4)2S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com