

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
分析 (1)橡胶的硫化不需要硫酸,表面活性剂“烷基苯磺酸纳”的合成需要硫酸作为反应物,铅蓄电池的生产中用硫酸作电解液,普钙的制备中用硫酸为反应物;
(2)根据SO2的转化率及生产成本来选择;
(3)由表中数据分析出温度和CuSO4的质量分数之间的关系,而CuSO4的质量取决于SO3 的质量,再由反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),△H=-98.3kJ•mol-1分析SO3 的质量和温度之间的关系;
(4)根据FeS2制取硫酸过程中涉及的化学反应方程式,利用关系法解题;
(5))从C为硫酸可知,b为阳离子交换膜,故a阴阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根,故D为氢氧化钠;阳极应为亚硫酸根放电生成硫酸根.
解答 解:(1)表面活性剂“烷基苯磺酸纳”的合成需要硫酸作为反应物,铅蓄电池的生产中用硫酸作电解液,普钙的制备中用硫酸为反应物,故选BCD;
(2)因为SO2与O2的反应是放热反应,所以选择的温度为400℃,而1个标准大气压时SO2的转化率已经很大,再增大压强,SO2的转化率提高不大,但会增加生产成本,所以选择0.1MPa,故答案为:400℃,0.1MPa;
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)),△H=-98.3kJ•mol-1反应制备SO3,该反应为可逆反应,正方向为放热,随着温度升高,平衡逆向移动,导致SO3的量减少,由CuO与SO3 在沸腾炉中化合而成CuSO4的量也减少;
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少);
(4)FeS2制取硫酸过程中,设生成的98%的硫酸为x吨,利用关系法列式,硫元素守恒,
FeS2 ~2H2SO4
120 2×98
1×36%×65% 98%x
所以:$\frac{120}{1×36%×65%}$=$\frac{2×98}{98%x}$,得x=0.39,故答案为:0.39;
(5)从C为硫酸可知,硫酸根来源于亚硫酸根放电.故a为阴离子交换膜,b为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故D为氢氧化钠;阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32--2e-+H2O=2H++SO42-,故答案为:阴;NaOH溶液;SO32--2e-+H2O=2H++SO42-.
点评 本题考查了工业制硫酸的生成过程和反应特征,二氧化硫的催化氧化反应的条件选择,尾气吸收的方法判断,二氧化硫接触室催化氧化反应的平衡移动,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
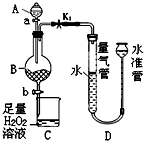 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
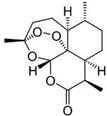
| A. | 化学是以实验为基础的一门学科,定量研究方法是化学发展为一门独立学科的重要标志之一 | |
| B. | 燃煤脱硫、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料、推广新能源汽车都能有效减少环境污染 | |
| C. | 我国科学家屠呦呦发现的青蒿素(结构见图),其中有类似于H2O2的结构,因此遇到强还原性的物质会变质 | |
| D. | 利用氢氧化铁胶体的“丁达尔效应“,可以除去水中的悬浮颗粒,从而达到净水的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入 碳粉一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定NO3-浓度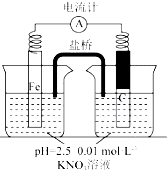 | Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
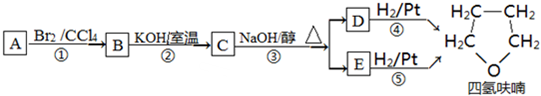
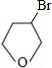 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$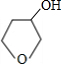 +NaBr.
+NaBr.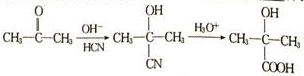 ,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成
,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成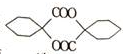 ,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)
,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)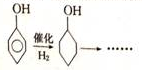
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+CO3-+2H2O | |
| C. | 0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com