
| A. | 反应CO(g)+NO2(g)=CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| B. | 实验室制备氢气,用粗锌代替纯锌,反应速率加快 | |
| C. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.反应为可逆反应,升高温度,平衡向逆方向移动,体系颜色加深,可用勒夏特列原理解释,故A不选;
B.粗锌能够形成原电池,导致反应速率加快,不能用勒夏特列原理解释,故B选;
C.铁离子在溶液中水解生成氢氧化铁和氢离子,将氯化铁加入盐酸中,可抑制铁离子水解,能够用勒夏特列原理解释,故C不选;
D.醋酸为弱酸,存在电离平衡,则将1mLpH=3的醋酸溶液加水稀释至l00mL,促进电离平衡移动,则测得其pH<5,能用勒夏特列原理解释,故D不选;
故选B.
点评 本题考查了勒夏特列原理的使用条件,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提,试题培养了学生的分析能力及灵活应用能力,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列我国古代技术应用中,其工作原理不涉及化学反应的是( )
A.黑火药爆炸 B.用铁矿石炼铁 C.湿法炼铜 D.转轮排字
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:选择题
实验室提供的下列各组混合物中,能用分液漏斗分离的是( )
A. 酒精和水 B. 碘和四氯化碳 C. 水和四氯化碳 D. 汽油和植物油
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
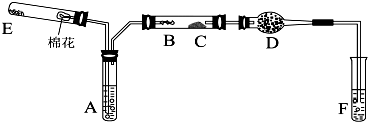
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 露置在空气中,容器内酸液的质量都减轻 | |
| B. | 浓硫酸可与铜反应制氢气 | |
| C. | 常温下铁与浓硝酸反应,产生大量的红棕色气体 | |
| D. | 浓硫酸和浓硝酸在常温下都能用铝制容器盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
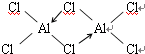 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com