
| A、它们的电子层数依次增多 |
| B、单质的活泼性依次减弱 |
| C、它们的氢化物的稳定性依次增强 |
| D、单质的颜色依次加深 |


科目:高中化学 来源: 题型:
| 核外电子排布的特点 | 元 素 符 号 |
| (1)最外层电子数为2的原子 | |
| (2)次外层电子数是最外层电子数2倍的原子 | |
| (3)最外层电子数是次外层电子数3倍的原子 | |
| (4)原子核内无中子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
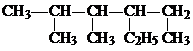 的名称是
的名称是 化合物A中含氧官能团的名称
化合物A中含氧官能团的名称查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有6个σ键、0个π键 |
| B、3个sp3杂化轨道形成σ键、1个sp3杂化轨道形成π键 |
| C、C-H之间是s轨道与sp2轨道形成的σ键,C与C之间是未参加杂化的2p轨道形成的σ键和π键 |
| D、C与C之间是sp2杂化轨道形成的一个σ键和未参加杂化的2p轨道形成的π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、①②④⑤ | B、③⑤⑥ |
| C、①⑤ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+02(g)=2H20(g);△H1=-Q1 2H2(g)+02(g)=2H20(1);△H2=-Q2 | ||||
| B、S(g)+O2(g)=S02(g);△H1=-Q1 S(s)+02(g)=S02(g);△H2=-Q2 | ||||
C、C(s)+
C(s)+02(g)=C02(g);△H2=-Q2 | ||||
D、H2(g)+Cl2(g)=2HCl(g);△H1=-Q1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液1mL稀释至100mL后,pH等于2 |
| B、向该溶液中加入等体积、pH为13的NaOH溶液恰好完全中和 |
| C、该溶液中H2SO4电离出的c(H+)与水电离出的c(H+)之比为10-12 |
| D、1L该溶液中含有H2SO4分子的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,22.4L苯所含分子数目为6.02×1023 |
| B、1mol/LK2SO4溶液所含K+数目为6.02×1023 |
| C、2g氢气所含的原子数为NA |
| D、在常温常压下,16gO2和O3的混合气体所含原子数目为6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com