
| A. | NaOH(NaOH) | B. | NaCl(HCl) | C. | CuCl2 (CuO) | D. | H2SO4 (H2SO4 ) |
分析 惰性电极电解下列溶液一段时间,加入一定质量的另一种物质(括号内),溶液可以完全复原,根据“析出什么加入什么”原则知,加入的物质相当于电解时析出的物质,据此分析解答.
解答 解:A.用惰性电解电解NaOH溶液时,阳极上生成O2、阴极上生成H2,所以析出的物质相当于H2O,要使溶液恢复原状,应该加入H2O,故A错误;
B.用惰性电极电解NaCl溶液时,阳极上生成Cl2、阴极上生成H2,所以析出的物质相当于HCl,要使溶液恢复原状,应该加入HCl,故B正确;
C.用惰性电极电解CuCl2 溶液时,阳极上生成Cl2、阴极上生成Cu,所以析出的物质相当于CuCl2,要使溶液恢复原状,应该加入CuCl2,故C错误;
D.用惰性电极电解H2SO4 溶液时,阳极上生成O2、阴极上生成H2,所以析出的物质相当于H2O,要使溶液恢复原状,应该加入H2O,故D错误;
故选B.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,熟练掌握电解池中离子放电顺序,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
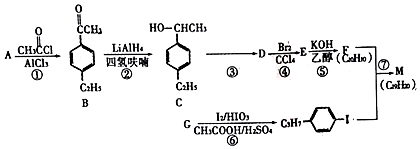
 +H≡C-H→
+H≡C-H→ =C+H,回答下列问题:
=C+H,回答下列问题: ,A的名称为乙苯.
,A的名称为乙苯. .
. 的合成路线:
的合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
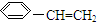 )的叙述错误的是( )
)的叙述错误的是( )| A. | 可以和溴水反应 | |
| B. | 分子中所有原子可能共面 | |
| C. | 是苯的同系物 | |
| D. | 1mol苯乙烯可以和4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
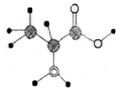 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
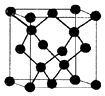 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 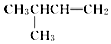 2-甲基-1-丁烯 2-甲基-1-丁烯 | ||
| C. | 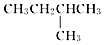 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
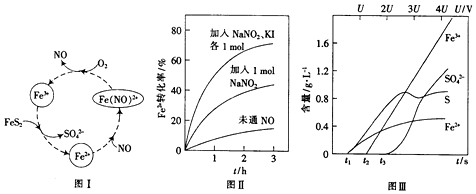
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | MgSO4•7H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com