
| A. | 钢管与铅连接,钢管可被保护 | |
| B. | 铁遇冷浓硫酸表面钝化,可保护内部不被腐蚀 | |
| C. | 纯铁比生铁更容易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+ |
分析 A.用电解原理保护金属时,金属应作电解池阴极;
B.常温下,铁和浓硝酸发生钝化现象而阻止进一步反应;
C.构成原电池负极的金属易被腐蚀;
D.钢铁发生析氢腐蚀时,负极上铁失电子生成亚铁离子.
解答 解:A.用电解原理保护金属时,金属应作电解池阴极,应该与原电池负极连接,故A错误;
B.常温下,铁和浓硝酸反应生成一层致密的氧化物薄膜而阻止了进一步反应,所以可以保护内部金属不被腐蚀,故B正确;
C.生铁中铁作原电池负极而容易被腐蚀,纯铁比生铁更耐腐蚀,故C错误;
D.钢铁发生析氢腐蚀时,负极反应是Fe-2e-═Fe2+,故D错误;
故选B.
点评 本题以金属的腐蚀与防护为载体考查了原电池和电解池原理,注意铁和铝的钝化现象不是没反应而是反应生成一层致密的氧化物薄膜而阻止了进一步反应,为易错点.


科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
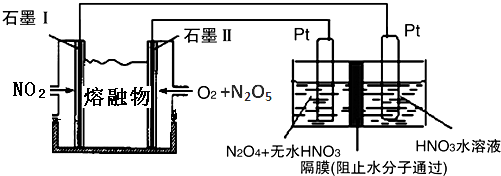
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
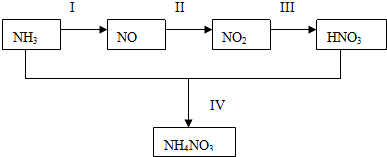
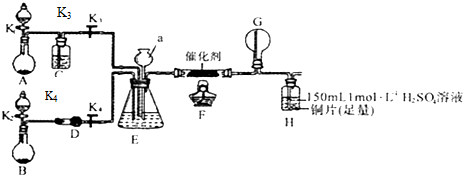
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O3与CO2的结构相似 | |
| B. | 硫粉不溶于水,易溶于酒精,难溶于CS2中 | |
| C. | Be(OH)2是两性氢氧化物 | |
| D. | 在相同条件下,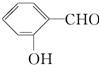 的沸点高于 的沸点高于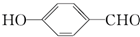 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间 | |
| B. | 化学反应达到最大限度时,正逆反应速率也达到最大且相等 | |
| C. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 | |
| D. | 用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酶是具有催化作用的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或重金属盐能使酶失去生理活性 | |
| D. | 酶只有在强酸性或强碱性条件下才能发挥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, ,
, .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com