
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 向盛l mL lmol•L-1AlCl3溶液的试管中加入3 mL10%NaF溶液,再加入l mL 3mol•L-1氨水,没有生成白色沉淀,其最主要的原因是氨水的浓度不够大,溶液的碱性不够 |
分析 A.可溶性淀粉溶液中滴加碘水,不存在碘分子;
B.原电池的反应速率大于Fe与酸的反应速率;
C.蒸发操作不能直接蒸干;
D.Al3+更易与F-结合成AlF63-.
解答 解:A.因为碘和淀粉形成络合物,不存在单独的碘分子,故不能被萃取,故A正确;
B.电化学反应较化学反应快,锌和铁在酸性条件下可形成原电池反应,反应速率较快,可用于判断,故B正确;
C.蒸发操作不能直接蒸干,以防止温度过高而导致分解而变质,故C正确;
D.若溶液中的铝离子与氟离子进化成新的物质,导致溶液中铝离子几乎不存在,加入氨水则不会生成氢氧化铝沉淀,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及萃取、原电池原理、实验基本操作、配合物等知识点,明确实验原理、物质性质及物质分离提纯方法是解本题关键,侧重考查学生分析及实验评价能力,易错选项是AD.


科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的物质易向溶解度更小的物质转化 | 澄清石灰水中通入CO2,石灰水变浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 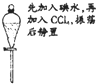 实验:液体分层,上层呈紫红色 | |
| B. |  实验:烧杯中先出现白色沉淀,后溶解 | |
| C. |  实验:试管中溶液颜色变为血红色 | |
| D. | 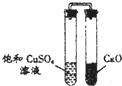 实验:放置一段时间后,饱和CuSO4溶液中出现白色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| B. | Cu2+与足量氨水反应的离子方程式 Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ | |
| C. | 抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快 | |
| D. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则
,则 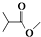 分子式:C5H8O2.
分子式:C5H8O2. .
. .
. 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: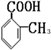 、
、 ;
; ,
,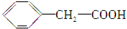 (任意两种)(任写其中二种).
(任意两种)(任写其中二种).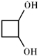 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.48 L N2和O2的混合气体中所含原子数为0.4NA | |
| B. | 常温下,1.0 L 1.0 mol•L-1NaAlO2溶液中含有的氧原子数为2NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com