

| A. | a极是直流电源的正极 | |
| B. | Fe极是阳极 | |
| C. | Pt极产生的气体体积是Ag极产生气体体积的2倍 | |
| D. | 硫酸铜溶液的浓度不变 |
分析 通电后观察到Cu极溶解,则Cu极为阳极,Fe极为阴极,故b、a、Pt、Ag极分别为:负极、正极、阳极、阴极,右池为电镀池,硫酸铜溶液的浓度不变,左边实质是电解水,以此解答.
解答 解:观察到Cu极溶解,则Cu极为阳极,Fe极为阴极,故b、a、Pt、Ag极分别为:负极、正极、阳极、阴极,右池为电镀池,硫酸铜溶液的浓度不变,左边实质是电解水.
A.Cu极溶解,应为电解池的阳极,阳极与电源的正极连,则a为正极,故A正确;
B.Fe连接电源的负极,为电解池的阴极,故B错误;
C.左边实质是电解水,2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,Pt为阳极发生氧化反应产生氧气,Ag为阴极发生还原反应产生氢气,则Ag极产生的气体体积是Pt极产生气体体积的2倍,故C错误;
D.右池为电镀池,硫酸铜溶液的浓度不变,故D正确;
故选AD.
点评 本题考查电解池知识,侧重于电极判断和电解池工作原理的考查,为高考常见题型,注意把握铜极的变化判断电极为解答该题的关键,难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 使体积不变,充水蒸气使体系压强增大 | |
| D. | 使压强不变,充氮气使容器体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲表示A、B 两物质的溶解度随温度变化情况,将tl℃时A、B 的饱和溶液分别升温至t2℃时(水不减少),溶质的质量分数B>A | |
| B. | 乙表示常温下,稀释HA、HB 两种酸的稀溶液时,溶液pH 随加水量的变化,则NaA 溶液的pH 小于同浓度的NaB 溶液的pH | |
| C. | 丙表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| D. | 丁表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A 对应的状态为化学平衡状 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3与盐酸 | B. | Cl2与NaOH溶液 | C. | Na2O2和CO2 | D. | Na2S2O3与稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L液态水中含有的H+数目为10-7 NA | |
| B. | 标准状况下,2.24 L D2O中含有的电子数为NA | |
| C. | 3.4g H2O2中含有的共用电子对数为0.1 NA | |
| D. | 1mol碳烯(:CH2)中含有的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
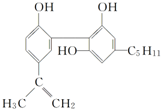 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图:
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构简式如图:| A. | 它的化学式为C20H24O3 | |
| B. | 从结构上看,它属于酚类 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
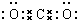 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为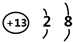 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com