
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有 性。(1分)
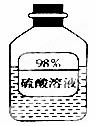
(2)某探究小组的同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定.取50g废水于烧杯中,加入足量BaCl2溶液、过滤、 洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
洗涤、干燥,得BaSO4固体11.65g.请解答下列问题:
①计算50g废水中H2SO4的溶质质量分数。(3分,要求写出计算过程)
②若改用KOH溶液(利用消耗的KOH的质量)测定50g废水中H2SO4的含量,结果可能会 ______(选填“偏低”、“偏高”或“不变”),原因是____________________。(每空
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
关于合成橡胶,下列说法正确的是 ( )。
A.热塑性丁苯橡胶兼有橡胶和塑料的性能
B.乙丙橡胶的单体是乙烯和丙烯
C.“尿不湿”就是不吸水
D.顺丁橡胶是特种合成橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
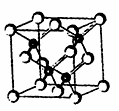
(1)镓的基态原子的电子排布式是 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。 (用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为 。
(5)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.空气是一种宝贵的资源 B.空气中氮气的质量分数为78%
C.氧气易溶于水,供给水生生物呼吸 D.汽车尾气随意排放,与雾霾形成无关
查看答案和解析>>
科目:高中化学 来源: 题型:
利用化学的知识,可解释生活中的现象。
(1)用活性炭可以除去冰箱中的异味,因为活性炭具有 性。
(2)氧化钙可作干燥剂,因为 ________。(用化学方程式回答)
(3)使用铁锅炒菜时,适当添加一些醋,有利于生成人体易吸收的亚铁离子,可有效防治的疾病是__________。
(4)用小苏打治疗胃酸过多,其反应化学方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于pH相同的醋酸和盐酸溶液,下列叙述中不正确的是
( )
A.取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n
B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸
C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多
D.两种酸溶液中c(CH3COO-)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平 衡常数 | Ka= 1.8×10-5 | Ka1= 4.3×10-7 | Ka2= 5.6×10-11 | Ka= 3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大的排列顺序是 (用编号填写)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数,理由是 。
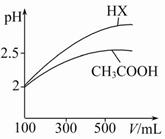
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积恒定的密闭容器中,一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃发生反应:2SO2+O2 2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g
D.达到平衡时,SO2的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.在离子晶体中,一定存在离子键
B.阳离子只有氧化性,阴离子只有还原性
C.纳米粒子分散到水中,有丁达尔现象
D.等离子体是由大量的带电微粒组成的,是继固体、液体、气体之后物质的另一种聚集状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com