
| A. |  能发生消去反应、酯化反应和加成反应 能发生消去反应、酯化反应和加成反应 | |
| B. | 硫酸铵溶液可以使蛋白质变性 | |
| C. | C4H10与C10H22一定互为同系物 | |
| D. | 分子式为C4H10O的有机物共2种 |
分析 A.不含碳碳不饱和键,不能发生加成反应;
B.硫酸铵可使蛋白质盐析;
C.根据同系物的定义判断;
D.分子式为C4H10O的有机物可为醇或醚.
解答 解:A.有机物含有羧基,可发生酯化反应,含有羟基,可发生消去反应,但不能发生加成反应,故A错误;
B.重金属盐可使蛋白质变性,但硫酸铵只能使蛋白质发生盐析,故B错误;
C.C4H10与C10H22都为烷烃,结构相似,为同系物,故C正确;
D.分子式为C4H10O的有机物可为醇或醚,对应的同分异构体有CH3CH2CH2CH2OH、CH3CHOHCH2CH3、CH3COH(CH3)2、CH30CH2CH2CH3等,大于2种,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的相关概念以及同分异构体的判断,难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的$\frac{1}{2}$ | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,正反应速率减小,逆反应速率增大 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
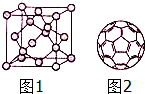 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.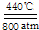 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
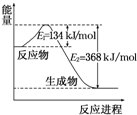 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com