
| A. | CH3CH2CH2CH2OH | B. | CH3CH2OH | ||
| C. | 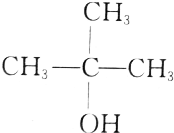 | D. | 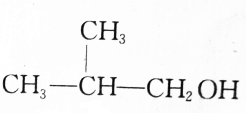 |
分析 利用消去反应原理,能够由醛或酮加氢还原制得的醇,醇中的羟基相连的碳原子上必须有氢原子;不能够由醛或酮加氢还原制得的醇,醇中的羟基相连的碳原子上没有有氢原子,能由醛加氢还原制得必须是与羟基相连的碳上有2个氢原子,据此进行判断.
解答 解:A.CH3CH2CH2CH2OH与羟基相连的碳原子上有2个氢原子,能够由CH3CH2CH2CHO加成反应生成,故A不选;
B.CH3CH2OH与羟基相连的碳原子上有2个氢原子,能够由CH3CHO加成反应生成,故B不选;
C.(CH3) 3COH羟基相连的碳原子上没有氢原子,不能够由醛或酮加氢还原制得,故C选;
D.(CH3) 2CHCH2OH与羟基相连的碳原子上有2个氢原子,能够由(CH3) 2CHCHO加成反应生成,故D不选;
故选C.
点评 本题考查了有机反应中加成反应和消去反应原理,注意合理分析有机物分子结构,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3- | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 新鲜肉 | 次鲜肉 | 变质肉 | |
| pH | 5.8-6.2 | 6.3-6.6 | 6.7以上 |
| A. | 不变 | B. | 变强 | C. | 变弱 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
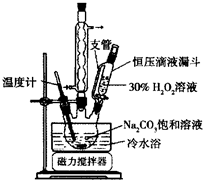 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
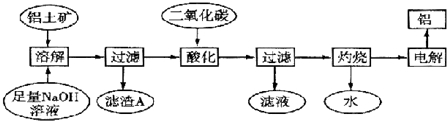
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com