
(7分)回答问题:
(1)甲、乙两试管分别盛有5 mLFeCl3溶液和5 mLFeCl2溶液,各滴入几滴KSCN溶液。填写下表:
|
试 样 |
滴入KSCN溶液后的现象 |
两试管里产生不同的现象有何用途 |
|
甲试管(FeCl3) |
|
|
|
乙试管(FeCl2) |
|
(2)在盛有3 mLFeCl3溶液的试管中加入少量铁粉,若充分反应后没有固体物剩余。该试管的溶液中存在什么金属阳离子?如何进一步得到肯定答案?
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
| 物质鉴定实验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为 CO32-、OH- CO32-、OH- ,C、D、E中含有的阳离子为H+、Al3+、Ag+ H+、Al3+、Ag+ |
| ②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 | A为 Na2CO3 Na2CO3 ,C含有的阳离子为H+ H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为 AgNO3 AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
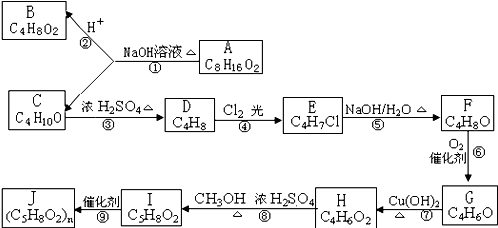
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com