

| A. | 断开1mol O-O键比断开1mol N-N键所需能量少448kJ | |
| B. | 断开1mol H-O键与断开1mol H-N键所需能量相差约72.6kJ | |
| C. | 由以上键能的信息可知H2O的沸点比NH3高 | |
| D. | 由元素非金属性的强弱可知H-O键比H-N键弱 |
分析 A.氧气中为O=O键,氮气中为N≡N键;
B.已知4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,根据焓变=反应物断键吸收热量-生成物形成化学键放出热量判断,H-O键与H-N的键能大小;
C.键能与沸点无关;
D.元素的非金属性越强,与H元素形成的化学键越稳定.
解答 解:A.根据II可知O=O键的键能比N≡N键的键能小,则断开1molO=O键比断开1mol N≡N键所需能量少448kJ,故A错误;
B.已知4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1269kJ/mol,则12H-N+3×498kJ/mol-2×946kJ/mol-12H-O=-1269kJ/mol,得(H-O)-(H-N)=72.6kJ/mol,所以断开1mol H-O键与断开1mol H-N键所需能量相差约72.6kJ,故B正确;
C.键能与沸点无关,沸点与分子间作用力有关,故C错误;
D.元素的非金属性越强,与H元素形成的化学键越稳定,非金属性:O>N,则H-O键比H-N键强,故D错误;
故选B.
点评 本题考查了化学键键能和焓变关系计算,图象分析判断,题目难度中等,侧重于考查学生的分析能力和计算能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
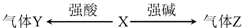
| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y在标况下的密度一定是1.96g•L-1 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实 验 现 象 | 可 以 肯 定 的 结 论 |
| A、观察混合气体无色 | 无Cl2、 |
| B、将混合气体通过浓H2SO4,体积减小 | 有NH3、无HCl |
| C、剩余气体跟空气接触后变为红棕色 | 有NO、无O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g N2与12g H2在密闭容器中反应,转移电子的数目为12.0×6.02×1023. | |
| B. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为6.02×1023 | |
| C. | 工业上用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子必为0.5×6.02×1023 | |
| D. | V L a mol•L-1 氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
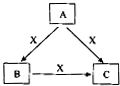 A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有机物X的含氧官能团有3种 | |
| B. | X分子中苯环上的一氯取代物有3种 | |
| C. | 在Ni作催化剂的条件下,1mol X 最多能与5 mol H2加成 | |
| D. | X在一定条件下能发生加成、取代、消去等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 石油化工中的裂化、裂解过程都是通过化学反应来获得气态烯烃 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com