
| A. | 1mol Na2SO4溶于水中,所得溶液中Na+个数为NA | |
| B. | 18g水含有电子数为8NA | |
| C. | 1L 0.3mol•L-1Na2SO4溶液中,含有Na+和SO42-总数为0.9NA | |
| D. | 1个氢气分子(H2)的质量为2g |
分析 A、1mol硫酸钠中含2mol钠离子;
B、求出18g水的物质的量,然后根据1mol水中含10mol电子来分析;
C、求出溶液中的硫酸钠的物质的量,然后根据1mol硫酸钠中含2mol钠离子和1mol硫酸根来分析;
D、1mol氢气的质量为2g;
解答 解:A、1mol硫酸钠中含2mol钠离子,故将1mol硫酸钠溶于水中后,溶液中的钠离子的个数为2NA个,故A错误;
B、18g水的物质的量为1mol,而1mol水中含10mol电子,即含10NA个,故B错误;
C、溶液中的硫酸钠的物质的量n=CV=0.3mol/L×1L=0.3mol,而1mol硫酸钠中含2mol钠离子和1mol硫酸根,故0.3mol硫酸钠中含0.9mol离子即0.9NA个,故C正确;
D、1mol氢气的质量为2g,而1mol氢气中含NA个氢气分子,故1个氢气分子的质量为m=$\frac{2}{{N}_{A}}$g,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
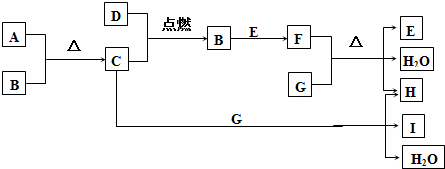
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2属于危险化学品,其标识应为: | |
| B. | 当你走进化学实验室之前,应认真阅读实验室的安全守则 | |
| C. | 中国大陆的火警报警电话为“119”,香港、澳门为“999” | |
| D. | 一般情况下,金属类物质着火时不宜使用二氧化碳类灭火器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
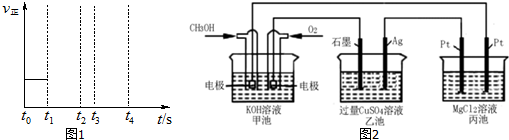
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体中每个Xn+周围有2个等距离且最近的N3- | |
| B. | Xn+中n=l | |
| C. | 该晶体中阳离子与阴离子个数比为3:1 | |
| D. | X元素的原子序数是19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑦ | C. | ③④⑥ | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1mol/L的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -41.1 kJ•mol-1 | B. | +200.7 kJ•mol-1 | C. | -766.5 kJ•mol-1 | D. | +41.1 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的质量比1:2 | B. | SiO2是还原剂 | ||
| C. | 反应中有6g碳被氧化 | D. | 反应中生成28gCO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com