
| 5 |
| 4 |
| 1 |
| 4 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种新元素 |
| B、4526Fe与5626Fe互为同素异形体 |
| C、它是一种新核素 |
| D、这是铁原子发生衰变放出两个质子形成的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68g硫酸铜,加入500mL水 |
| B、称取12.0g胆矾配成500mL溶液 |
| C、称取8.0g硫酸铜配成500mL溶液 |
| D、称取12.5g胆矾配成480mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Zn |
| B、Mg和Fe |
| C、A1和Na |
| D、A1和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种微粒,若核外电子排布完全相同,其化学性质也一定相同 |
| B、凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C、两种原子若核外电子排布相同,则一定属于同种元素 |
| D、存在两种质子数和电子数均相同的阳离子和阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
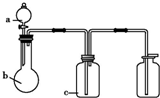 图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的
图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
| C | NO | 稀HNO3 | 铜屑 | H2O |
| D | Cl2 | 浓盐酸 | 高锰酸钾 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com