
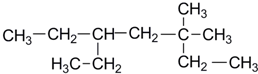
 ,则该烃的可能的结构有几种( )
,则该烃的可能的结构有几种( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.
根据加成原理采取逆推法还原C≡C,烷烃分子中相邻碳原子上至少均带2个氢原子的碳原子间是对应炔烃存在C≡C三键的位置.
还原三键时注意:先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的2个氢原子形成三键.
解答 解:根据炔烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置.该烷烃的碳链结构为 ,3号碳原子上无H原子,5号碳原子上有1个H原子,故3号和5号碳原子均不能与相邻的碳原子形成C≡C,能形成三键位置有:1和2之间;6和7之间,8和9之间,6和7与8和9形成的碳碳三键位置相同,故该炔烃共有2种.
,3号碳原子上无H原子,5号碳原子上有1个H原子,故3号和5号碳原子均不能与相邻的碳原子形成C≡C,能形成三键位置有:1和2之间;6和7之间,8和9之间,6和7与8和9形成的碳碳三键位置相同,故该炔烃共有2种.
故选C.
点评 本题以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C≡C,注意分析分子结构是否对称,防止重写、漏写,题目难度中等.


科目:高中化学 来源: 题型:选择题
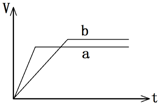 某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )| A. | 向试管中滴加少许硫酸铜溶液 | B. | 在反应过程中对试管加热 | ||
| C. | 用铁粉代替铁片 | D. | 用98%的浓硫酸代替稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X | B. | 最高价氧化物的水化物的酸性:R>W | ||
| C. | 气态氢化物的稳定性:X>W | D. | 单质与水(或酸)反应的剧烈程度:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  +CH${\;}_{{\;}_{3}}$CH2OH→ +CH${\;}_{{\;}_{3}}$CH2OH→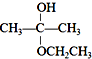 加成反应 加成反应 | |
| C. | HOCH2CH2CH2OH$\stackrel{浓硫酸}{→}$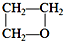 +H2O消去反应 +H2O消去反应 | |
| D. | nCH2=O$\stackrel{一定条件}{→}$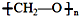 加聚反应 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
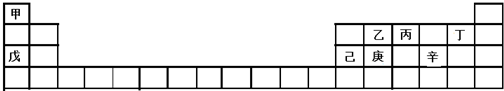
| A. | 甲、戊、己的单质都是金属 | |
| B. | 乙、丙、丁的氢化物稳定性依次增强 | |
| C. | 庚的氧化物不能和丁的氢化物反应 | |
| D. | 己的氧化物能分别与戊和辛的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 方法 | |
| A | 乙烷 | 乙烯 | 一定条件下与H2反应使乙烯转化为乙烷 |
| B | 乙炔 | H2S | 通入CuSO4溶液的洗气瓶洗气 |
| C | 溴苯 | Br2 | 加NaOH溶液后分液 |
| D | 工业酒精 | H2O(转为无水酒精) | 加入生石灰,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数比内层电子总数少4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 与氢形成的气态化合物在标准状况下的密度为0.76g•L-1 |
| Z | 元素最高正价与负价的绝对值之差是6 |
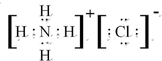 .
.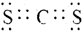 .
. ,
,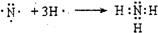 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
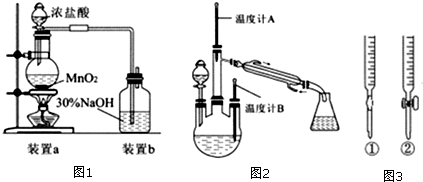
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com