
【题目】下列有关热化学方程式及其叙述正确的是 ( )
A.H2的燃烧热为285.8 kJ·mol-1,则H2O电解生成H2和O2的热化学方程式为2H2O(l)=2H2(g)+O2(g)ΔH=+285.8 kJ·mol-1
B.1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) ΔH=-445 kJ·mol-1
CO2(g)+H2O(l) ΔH=-445 kJ·mol-1
C.已知H2(g)+Cl2(g)=2HCl(g) ΔH=-Q(Q>0) kJ·mol-1,则H2的燃烧热为Q kJ·mol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol
【答案】B
【解析】
A. 燃烧热表示的是1 mol某物质完全燃烧生成稳定氧化物的热效应,所以285.8 kJ·mol-1是1 mol氢气的能量变化,则H2O电解的热化学方程式应该为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+285.8×2 kJ·mol-1=+571.6 kJ·mol-1,故A错误;
2H2(g)+O2(g) ΔH=+285.8×2 kJ·mol-1=+571.6 kJ·mol-1,故A错误;
B. 1 mol甲烷燃烧放出890 kJ·mol-1,所以0.5 mol甲烷燃烧放出445 kJ·mol-1,故B正确;
C. H2的燃烧热是指1molH2完全燃烧生成液态水的热效应,故C错误;
D. HF是一元弱酸,HF的电离会吸热,所以放热应该小于57.3 kJ,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是

A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)命名下列有机物:HOCH2CH2CHO_____, ________。
________。
(2)燃烧某有机物A 1.50 g,生成1.12 L(标准状况)CO2和0.05 mol H2O,该有机物的蒸气对空气的相对密度是1.04,则该有机物的分子式为_____。
(3)已知端炔烃在催化剂存在下可发生偶联反应:2RC≡CH![]() RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
已知: ,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的沉淀溶解平衡为AgCl(s)![]() Ag+(aq)+Cl(aq),下列说法中错误的是( )
Ag+(aq)+Cl(aq),下列说法中错误的是( )
A.向AgCl悬浊液中加少量水,c(Ag+)一定减小
B.AgCl饱和溶液中c(Ag+)=![]() mol/L
mol/L
C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
A. 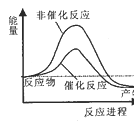 B.
B.  C. C
C. C D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g),反应过程中的能量变化如图所示,下列说法正确的是( )

A.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量为270 kJ
B.氟化氢气体分解生成氢气和氟气的反应是放热反应
C.在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量
D.其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)常温下,回答下列问题:(提示:lg2 = 0.3)
(1)pH=4的硫酸溶液中,由水电离出的氢离子浓度为____________________________;
(2)将pH=11的氢氧化钡稀释105倍后pH为____________________________________;
(3)将pH=11的氨水稀释100倍后pH范围为___________________________________;
(4)将pH=2的盐酸与pH=5的硫酸等体积混合后pH为__________________________;
(5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,且a+b=13,则V酸:V碱=________。
(II)反应A(s)+2B(g)2C(g)在密闭容器中达到平衡。
(1)若升高温度能使C的物质的量减小,则正反应是___(填“吸热”或“放热”)反应。
(2)若增加A的物质的量,平衡________(填“正向”或“逆向”或“不”)移动。
(3)若增大压强,平衡________(填“正向”或“逆向”或“不”)移动。
(4)若增加C的浓度,B(g)的转化率________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com