
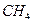 £Øg£©+
£Øg£©+ 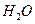 £Øg£©====
£Øg£©====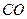 £Øg£©+
£Øg£©+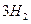 £Øg£©
£Øg£©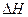 =
= 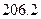
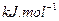
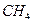 £Øg£©+
£Øg£©+ 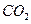 £Øg£©====
£Øg£©==== £Øg£©+
£Øg£©+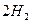 £Øg£©
£Øg£©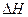 =
= 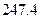
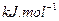
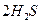 £Øg£©====
£Øg£©====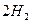 £Øg£©+
£Øg£©+ £Øg£©
£Øg£© 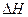 =
= 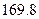
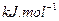
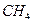 £Øg£©Óė
£Øg£©Óė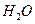 £Øg£©·“Ӧɜ³É
£Øg£©·“Ӧɜ³É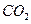 £Øg£©ŗĶ
£Øg£©ŗĶ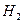 £Øg£©µÄČČ»Æѧ·½³ĢŹ½ĪŖ______”£
£Øg£©µÄČČ»Æѧ·½³ĢŹ½ĪŖ______”£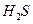 ČČ·Ö½āÖĘĒāŹ±£¬³£Ļņ·“Ó¦Ę÷ÖŠĶØČėŅ»¶Ø±ČĄżæÕĘų£¬Ź¹²æ·Ö
ČČ·Ö½āÖĘĒāŹ±£¬³£Ļņ·“Ó¦Ę÷ÖŠĶØČėŅ»¶Ø±ČĄżæÕĘų£¬Ź¹²æ·Ö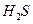 Č¼ÉÕ£¬ĘäÄæµÄŹĒ_____;Č¼ÉÕÉś³ÉµÄ
Č¼ÉÕ£¬ĘäÄæµÄŹĒ_____;Č¼ÉÕÉś³ÉµÄ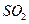 Óė
Óė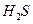 ½ųŅ»²½·“Ó¦£¬Éś³ÉĪļŌŚ³£ĪĀĻĀ¾ł·ĒĘųĢ壬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_______”£
½ųŅ»²½·“Ó¦£¬Éś³ÉĪļŌŚ³£ĪĀĻĀ¾ł·ĒĘųĢ壬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_______”£ OµÄČČ·Ö½āŅ²æɵƵ½H
OµÄČČ·Ö½āŅ²æɵƵ½H £¬øßĪĀĻĀĖ®·Ö½āĢåĻµÖŠÖ÷ŅŖĘųĢåµÄĢå»ż·ÖŹżÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼11ĖłŹ¾”£Ķ¼ÖŠA”¢B±ķŹ¾µÄĪļÖŹŅĄ“ĪŹĒ_______”£
£¬øßĪĀĻĀĖ®·Ö½āĢåĻµÖŠÖ÷ŅŖĘųĢåµÄĢå»ż·ÖŹżÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼11ĖłŹ¾”£Ķ¼ÖŠA”¢B±ķŹ¾µÄĪļÖŹŅĄ“ĪŹĒ_______”£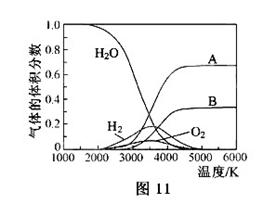
 )
) ]µÄ¼īŠŌČÜŅŗÖĘĒāµÄ×°ÖĆŹ¾ŅāĶ¼¼ūĶ¼12£Øµē½ā³ŲÖŠøōĤ½ö×čÖ¹ĘųĢåĶعż£¬Ņõ”¢Ńō¼«¾łĪŖ¶čŠŌµē¼«£©”£µē½āŹ±£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ_______”£
]µÄ¼īŠŌČÜŅŗÖĘĒāµÄ×°ÖĆŹ¾ŅāĶ¼¼ūĶ¼12£Øµē½ā³ŲÖŠøōĤ½ö×čÖ¹ĘųĢåĶعż£¬Ņõ”¢Ńō¼«¾łĪŖ¶čŠŌµē¼«£©”£µē½āŹ±£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ_______”£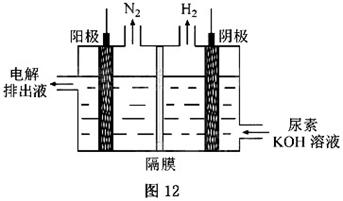
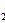 CuŹĒŅ»ÖÖ“¢ĒāŗĻ½š”£350”ꏱ£¬Mg
CuŹĒŅ»ÖÖ“¢ĒāŗĻ½š”£350”ꏱ£¬Mg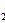 CuÓėH
CuÓėH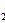 ·“Ó¦£¬Éś³ÉMgCu
·“Ó¦£¬Éś³ÉMgCu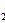 ŗĶ½öŗ¬Ņ»ÖÖ½šŹōŌŖĖŲµÄĒā»ÆĪļ£ØĘäÖŠĒāµÄÖŹĮæ·ÖŹżĪŖ0.077£©”£Mg
ŗĶ½öŗ¬Ņ»ÖÖ½šŹōŌŖĖŲµÄĒā»ÆĪļ£ØĘäÖŠĒāµÄÖŹĮæ·ÖŹżĪŖ0.077£©”£Mg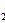 CuÓėH
CuÓėH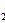 ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______”£
·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_______”£
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 O 2£Øg£©==H2O£Øg£© ¦¤H="a" kJ”¤mol-1£»
O 2£Øg£©==H2O£Øg£© ¦¤H="a" kJ”¤mol-1£» O 2£Øg£©==H2O£Øl£© ¦¤H="b" kJ”¤mol-1£»
O 2£Øg£©==H2O£Øl£© ¦¤H="b" kJ”¤mol-1£»| A£®a<b | B£®a”¢b”¢c¾łĪŖÕżÖµ | C£®a=b | D£®2b=c |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®100KJ | B£®60KJ | C£®50KJ | D£®30KJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CO2 (g)+ H2 (g)·“Ó¦¹ż³ĢÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾£¬øĆ·“Ó¦ĪŖ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©£¬·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ ”£
CO2 (g)+ H2 (g)·“Ó¦¹ż³ĢÄÜĮæ±ä»ÆČēÓŅĶ¼ĖłŹ¾£¬øĆ·“Ó¦ĪŖ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©£¬·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ ”£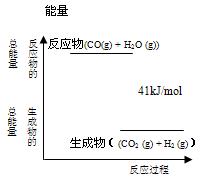
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
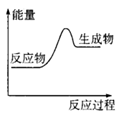
| A£®Ć¾ÓėŃĪĖį·“Ó¦ |
| B£®ÉśŹÆ»ŅÓėĖ®·“Ó¦ |
| C£®Ģ¼ŌŚæÕĘųÖŠČ¼ÉÕ |
| D£®ĀČ»Æļ§ŗĶĒāŃõ»Æ±µ¾§Ģå·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| ·½·Ø¢ń | ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuO |
| ·½·Ø¢ņ | µē½ā·Ø£¬·“Ó¦ĪŖ2Cu + H2O  Cu2O + H2”ü”£ Cu2O + H2”ü”£ |
| ·½·Ø¢ó | ÓĆėĀ£ØN2H4£©»¹ŌŠĀÖĘCu(OH)2 |

 ³öN2”£øĆÖĘ·ØµÄ»Æѧ·½³ĢŹ½ĪŖ ”ų ”£
³öN2”£øĆÖĘ·ØµÄ»Æѧ·½³ĢŹ½ĪŖ ”ų ”£ ”÷H>0£¬Ė®ÕōĘųµÄÅضČĖꏱ¼ät±ä»ÆČēĻĀ±ķĖłŹ¾”£
”÷H>0£¬Ė®ÕōĘųµÄÅضČĖꏱ¼ät±ä»ÆČēĻĀ±ķĖłŹ¾”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ·“Ó¦³żĮĖÉś³ÉŠĀĪļÖŹĶā£¬»¹°éĖę×ÅÄÜĮæµÄ±ä»Æ |
| B£®·ÅČČ·“Ó¦²»ŠčŅŖ¼ÓČČ¼“æÉ·¢Éś |
| C£®ŠčŅŖ¼ÓČČĢõ¼žµÄ»Æѧ·“Ó¦¶¼ŹĒĪüČČ·“Ó¦ |
| D£®»Æѧ¼ü¶ĻĮŃŹĶ·ÅÄÜĮ棬»Æѧ¼üŠĪ³ÉŠčŅŖĪüŹÕÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ±ä»ÆÖŠ°éĖęÄÜĮæ±ä»ÆµÄÖ÷ŅŖŌŅņŹĒÓŠ»Æѧ¼üµÄ¶ĻĮŃŗĶŠĪ³É |
| B£®Čē¹ūij·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÄĒĆ“øĆ·“Ó¦ĪŽŠč¼ÓČČ¾ĶŅ»¶ØÄÜ·“Ó¦ |
| C£®ŌŚĶ”¢ŠæŗĶĻ”ĮņĖį¹¹³ÉµÄŌµē³ŲÖŠ£¬ŠæŹĒøŗ¼« |
| D£®ŹÖ»śµē³ŲŌŚ³äµēŹ±£¬ŹĒµēÄÜ×Ŗ±äĪŖ»ÆѧÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®·ÅČČ·“Ó¦²»Šč¼ÓČČ¾ĶÄÜ·¢Éś |
| B£®1molæÉČ¼ĪļČ¼ÉÕÉś³ÉŃõ»ÆĪļ·Å³öµÄČČĮæ¾ĶŹĒøĆĪļÖŹµÄČ¼ÉÕČČ |
| C£®·“Ó¦Īļ×ÜÄÜĮæ“óÓŚÉś³ÉĪļ×ÜÄÜĮæµÄ·“Ó¦ŹĒ·ÅČČ·“Ó¦ |
| D£®Ēæµē½āÖŹČÜŅŗµÄµ¼µēÄÜĮ¦±ČČõµē½āÖŹČÜŅŗµÄµ¼µēÄÜĮ¦Ēæ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com