
分析 (1)根据铬的核外电子排布规律可知,铬在最外层是N层,有2个电子,据此答题;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素;
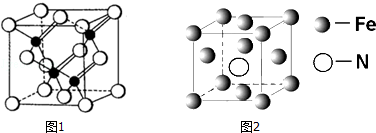
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,据此判断;
(4)与As同主族的短周期元素是N、P,所经AsH3的结构应与NH3相似,NH3分子之间有氢键,沸点较高;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为1×$\frac{1}{8}$+6×$\frac{1}{2}$=4,进而确定氮化铁的化学式,根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)铬的核外电子排布式为1s22s22p63s23p63d54s1,所以铬在最外层是N层,有1个电子,N层上原子轨道为spdf四种,共有轨道数为1+3+5+7=16,
故答案为:N;16;1;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素,30Zn的4s能级有2个电子,处于全满状态,较稳定,所以30Zn与31Ga的第一电离能不符合逐渐增大的规律,
故答案为:否;30Zn的4s能级有2个电子,处于全满状态,较稳定;
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,所以每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体,
故答案为:4;正四面体;
(4)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构应与NH3相似,AsH3中心原子杂化的类型为sp3,NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3.PH3的混合气体降温是首先液化的是NH3,
故答案为:sp3;NH3;NH3分子之间有氢键,沸点较高;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为1×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以氮化铁的化学式Fe4N,晶胞的体积为a3cm3,所以ρ=$\frac{m}{V}$=$\frac{\frac{14+56×4}{N{\;}_{A}}}{a{\;}^{3}}$g.cm-3=$\frac{238}{N{\;}_{A}a{\;}^{3}}$g.cm-3,
故答案为:Fe4N;$\frac{238}{N{\;}_{A}a{\;}^{3}}$.
点评 本题考查较为综合,原子结构、第一电离能、晶胞的结构及晶体计算、氢键等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定.


科目:高中化学 来源: 题型:解答题
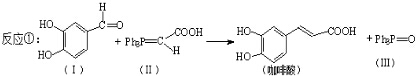
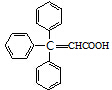 ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为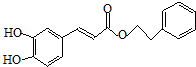 .
.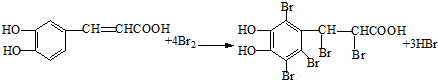 .
.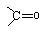
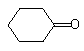 的芳香化合物共有3种
的芳香化合物共有3种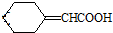 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
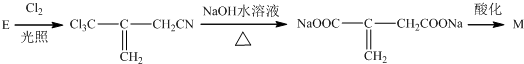
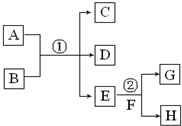 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
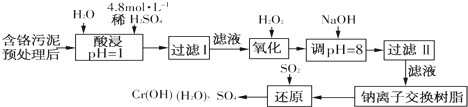
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
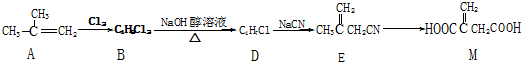
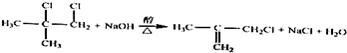
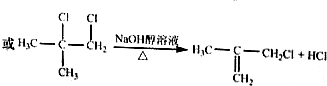 .
. (只写一种)
(只写一种)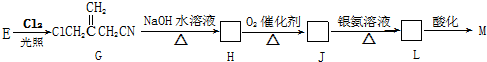
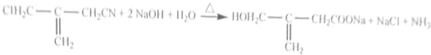
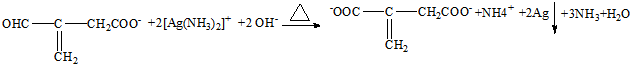
 (实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)
(实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向负极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 在铝表面的反应为:Al-3e-═Al3+ | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
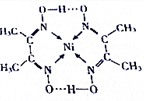 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com