
【题目】常温下,用0.1mol/L NaOH溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图。下列说法错误的是:

A.点①所示溶液中:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点①②③所示溶液中,均成立:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.点③表示整个滴定过程恰好达到滴定终点,在过程中溶液中![]() 始终不变
始终不变
【答案】A
【解析】
A. 点①所示溶液中,滴入10mL氢氧化钠溶液,则反应后溶液中溶质为等浓度的醋酸钠和醋酸,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则:c(H+)>c(OH-)、c(CH3COO-)>c(CH3COOH),结合物料守恒可得:c(CH3COO-)>c(Na+) >c(CH3COOH),A项错误;
B. 点②所示溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因pH=7,则c(H+)=c(OH-),结合电荷守恒式可知c(Na+)=c(CH3COO-),因溶质为醋酸钠与醋酸,满足c(Na+)=c(CH3COO-)>c(H+)=c(OH-),B项正确;
C. 点①②③所示溶液中,均满足电荷守恒则有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),C项正确;
D.![]() 可变形为
可变形为![]() ,由于滴定过程中醋酸的电离平衡常数始终不变,则
,由于滴定过程中醋酸的电离平衡常数始终不变,则![]() 的值始终不变,D项正确。
的值始终不变,D项正确。
答案选A。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】某课外化学兴趣小组欲从铝土矿中提取少量的Al2O3,查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
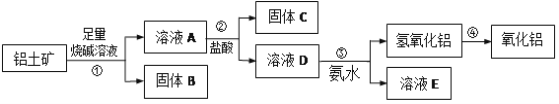
(1)固体B的主要用途为(只写一种即可)______;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应。发生反应的离子方程式是:______
(3)第③步的实验操作名称是______,请简述洗涤的操作过程______。若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与炭、Cl2在高温条件下反应,已知每消耗0.5mol炭单质,转移1mol电子,则该反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-===2Mn2++5SO42-+4H+
B.FeCl3溶液腐蚀铜板:2Fe3++Cu===2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O====2
+CO2+H2O====2![]() +CO32-
+CO32-
D.酸性碘化钾溶液中滴加适量双氧水:2I+2H++H2O2===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
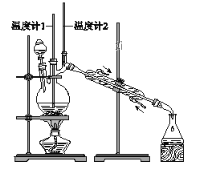
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
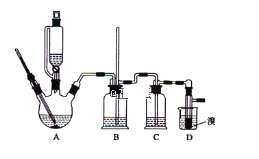
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)+270KJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270KJ
D.该反应过程的能量变化可用图来表示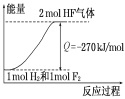
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式:
① ![]() ;②
;② ![]() ;③
;③ ![]() ;④
;④ ![]() 。
。
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)实验中应选用___作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:___。
(3)第一次滴定前后,碱式滴定管中的液面位置如图所示,则V标=__mL。
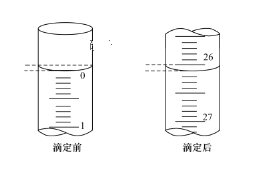
(4)下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。
正确的操作顺序是____
A.⑤④③②①⑥ B.⑤①②⑥④③
C.③⑥①②⑤④ D.③⑥①②④⑤
(5)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ.滴定前未用标准液润洗碱式滴定管___;
Ⅱ.滴定结束时俯视滴定管刻度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:
Ⅰ.CO(g)+2H2(g) ![]() CH3OH(g)△H1
CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g)△H3
CO2(g)+H2(g)△H3
回答下列问题
(1)反应(Ⅰ)的△S________(填“>”或“<”)0,△H1=________(用△H2、△H3表示)。
(2)上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
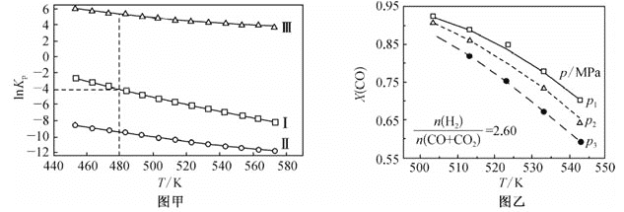
①反应(Ⅱ)的△H________(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=________。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=________(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)若用CO和CO2混合气体合成甲醇,起始时均控制 ![]() =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
=2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是_____(填字母)。
A p1<p2<p3
B 升高温度,反应速率和X(CO)均减小
C 起始时若p2=7.2MPa,则H2的分压为5.2MPa
D 其他条件不变,增大 ![]() ,X(CO)增大
,X(CO)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com