
| A. | 一定是单质 | B. | 一定是混合物 | ||
| C. | 可能是单质也可能是化合物 | D. | 可能单质是也可能是混合物 |
科目:高中化学 来源: 题型:解答题
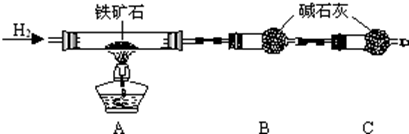
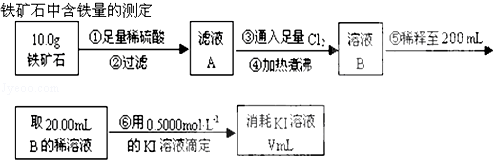
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的CO2通入氨水中:CO2+NH3•H2O═NH4++HCO3- | |
| B. | 除去CO2中的HCl气体:CO32-+2H+═CO2+2H2O | |
| C. | 自然界中溶洞的形成:CaCO3+CO2+2H2O═Ca2++2HCO3- | |
| D. | 用烧碱溶液吸收氯气的反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体通入过氧化钠:2SO2+2Na2O2═2Na2SO3+O2↑ | |
| B. | 金属铝投入NaOH溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| C. | 硫酸亚铁与酸性高锰酸钾反应:3Fe2++MnO${\;}_{4}^{+}$+4H+=3Fe3++MnO2↓+2H2O | |
| D. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )| A. | 使用催化剂,C的百分含量增大 | |
| B. | 升温,化学平衡向正反应方向移动 | |
| C. | 化学方程式的化学计量数关系m+n>e+f | |
| D. | 该反应是一个放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
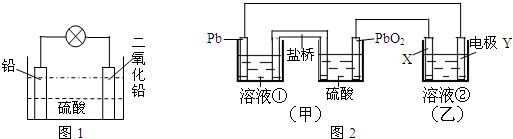
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO${\;}_{3}^{2-}$) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3OONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com