
【题目】短周期元素的离子:![]() 具有相同的电子层结构,下列关系中不正确的是( )
具有相同的电子层结构,下列关系中不正确的是( )
A. 质子数:![]() B. 还原性:
B. 还原性:![]()
C. 氧化性:![]() D. 半径:
D. 半径:![]()
【答案】A
【解析】
短周期元素的离子:![]() 具有相同的电子层结构,则一定满足a-3=b-1=c+2=d+1,其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。
具有相同的电子层结构,则一定满足a-3=b-1=c+2=d+1,其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。
A.根据a-3=b-1=c+2=d+1,所以质子数:![]() ,故选A;
,故选A;
B.同周期自左向右原子半径逐渐减小,非金属性逐渐增强,非金属性越强,相应阴离子的还原性就越弱,还原性:![]() ,故不选B;
,故不选B;
C.同周期自左向右原子半径逐渐减小,金属性逐渐减弱,金属性越强,离子氧化性越弱,氧化性:![]() ,故不选C;
,故不选C;
D.当电子层结构相同时,核电荷数越大,吸电子能力越强,半径越小,半径:![]() ,故不选D;
,故不选D;
答案:A


科目:高中化学 来源: 题型:
【题目】磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1
H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g)的ΔH4=_________kJ·mol-1。
H2O(g)的ΔH4=_________kJ·mol-1。
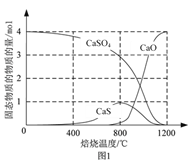
⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如图1所示。在低于800 ℃时主要还原产物为___________;高于800 ℃时主要发生的反应的化学方程式为___________。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是___________;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___________。

③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___________。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)![]() CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
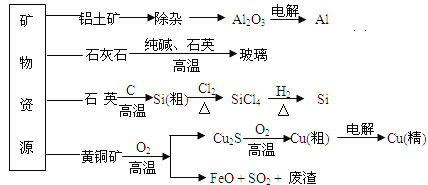
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构和元素周期表的相关知识回答下列问题:
I.用A+、B-、C2-、D表示含有18个电子的离子或分子。请填空:
(1)A元素是__________,B元素是__________,C元素是__________。(用元素符号表示)
(2)物质D由两种元素组成,每个分子中含有三个原子,其分子式是________,电子式是______________。
Ⅱ.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
回答下列问题:
(1)Y在元素周期表中的位置为______________,
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______________ (写化学式),非金属气态氢化物还原性最强的是______________(写化学式)。
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物的电子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用如图装置可验证同主族元素非金属性的变化规律
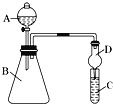
(1)仪器A的名称为______________,干燥管D的作用是______________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,装置C中的实验现象为淀粉溶液变蓝,写出使淀粉溶液变蓝的离子方程式__________________________________________。
(3)实验室中现有药品:①稀盐酸 ②稀硫酸 ③Na2SiO3溶液 ④Na2CO3 ⑤CaCO3固体,请选择合适药品设计实验验证C、Si、S的非金属性的变化规律;装置A、B中所装药品分别为_______、____________。(填序号)
Ⅱ.试用Zn+Cu2+===Zn2++Cu的反应设计原电池。
(1)原电池中使用的电解质溶液是__________________;
(2)写出电极反应式:负极:___________________________;正极______________________________;
(3) 当导线中有6.02×1023个电子通过时,电池负极质量减少____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)
A. 此反应中水既不是氧化剂又不是还原剂
B. 试管内溶液中溶质的物质的量浓度为1/22.4mol/L
C. 溶液体积占试管容积的三分之二
D. 若将试管中的气体换为氯化氢或者氨气,则水充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
⑴ O2-的电子式为___________;
⑵ O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
⑶ CH3OH在常温下为液态,沸点高于乙烷的主要原因是__________________________;
⑷ Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用____________________________。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是_________________。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中
c(Cl-) : c(ClO-)=11 : 1时,则c(ClO-) :c(ClO3-)比值等于_____________。
⑸ 镁是一种较活泼的金属, Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com