
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 硫酸、盐酸、氢氟酸均为强酸 | D. | 氯水、水玻璃、氨水均为混合物 |
分析 A.和碱反应生成盐和水的氧化物为酸性氧化物,反应为复分解反应;
B.分散质粒子直径介于1nm-100nm的分散系属于胶体;
C.水溶液中完全电离的酸为强酸;
D.由两种或两种以上物质组成的物质属于混合物.
解答 解:A、CO属于不成盐氧化物,不是酸性氧化物,故A错误;
B、硅酸属于纯净物不是分散系,不是胶体,氯化铁溶液不是胶体,故B错误;
C、硫酸、盐酸均为强酸,氢氟酸为弱酸,故C错误;
D、氯水是氯气的水溶液、水玻璃是硅酸钠的水溶液、氨水是氨气的水溶液均为多种物质组成的混合物,故D正确.
故选D.
点评 本题考查了物质的分类,涉及酸性氧化物、胶体、强酸弱酸、混合物等概念的理解,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Zn与稀H2SO4反应:2Zn+2H+═2Zn2++H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | 硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
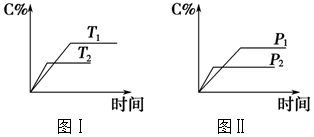
| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
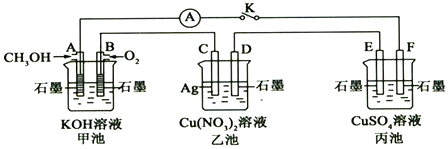
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa与O2完全反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| B. | 88.0g14CO2与14N2O的混合物中所含中子数为44NA | |
| C. | 0.1L,l.0mol/L的NaAlO2水溶液中含有的氧原子数为0.2NA | |
| D. | 室温下,将1mol铁片投入到0.5L,18.4mol/L的硫酸中,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | 蛋白质受热变性 | 用高温加热的方法杀死流感病毒 |
| B | 明矾溶液显酸性 | 用明矾溶液清除铜镜表面的铜锈 |
| C | Na2CO3溶液显碱性 | 用热的纯碱溶液洗去油污 |
| D | P2O5具有吸水性 | 用P2O5干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com