
·ÖĪö £Ø1£©Ńõ»Æ»¹Ō·“Ó¦ÖŠ£¬»ÆŗĻ¼ŪÉżøßµÄŌŖĖŲŌŚ·“Ó¦ÖŠ±»Ńõ»Æ£¬øł¾Żµē×ÓŹŲŗćČ·¶Ø×ŖŅʵē×ÓµÄĮæÓė¶žŃõ»ÆĮņµÄĮæÖ®¼äµÄ¹ŲĻµ£»
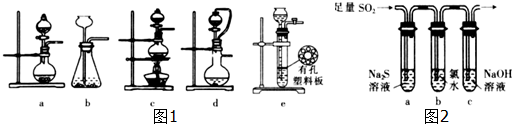
£Ø2£©¢ŁŹµŃéŹŅæÉÓĆ70%µÄÅØĮņĖįŗĶŃĒĮņĖįÄĘ·“Ó¦ÖĘČ”¶žŃõ»ÆĮņ£¬ĪŖ¹ĢĢåÓėŅŗĢå·“Ó¦²»¼ÓČČ×°ÖĆ£¬ÄÜæŲÖĘ·“Ó¦ĖŁ¶Č£¬ĄūÓĆ·ÖŅŗĀ©¶·æŲÖĘŅŗĢåµÄ¼ÓČė£»
¢ŚÓÉĮņŹŲŗćæÉµĆ£ŗNa2SO3”«SO2£¬øł¾Ż¹ŲĻµŹ½¼°¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæ¼ĘĖć³öŠčŅŖŃĒĮņĖįÄʵÄÖŹĮ棻Éčƻӊ±äÖŹµÄŃĒĮņĖįÄĘĪŖ100g£¬øł¾Ż±äÖŹµÄÖŹĮæ¼ĘĖć³ö±äÖŹŗóČÜŅŗÖŠŃĒĮņĖįÄʵÄÖŹĮæ·ÖŹż£¬ŌŁ¼ĘĖć³öŠčŅŖ±äÖŹŗóµÄŃĒĮņĖįÄʵÄÖŹĮ棻
£Ø3£©¢Ł¶žŃõ»ÆĮņ¾ßÓŠŃõ»ÆŠŌ£¬æÉŅŌŗĶ×īµĶ¼ŪµÄĮņ»ÆÄĘ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£»
¢ŚĀČĖ®ÖŠŗ¬ÓŠĀČĘų£¬ĀČĖ®ÖŠ»¹ŗ¬ÓŠ“ĪĀČĖį”¢HCl£¬ĀČĘų¾ßÓŠŃõ»ÆŠŌ£¬æÉŅŌ½«¶žŃõ»ÆĮņŃõ»Æµ½×īøß¼ŪµÄĮņĖį£®
½ā“š ½ā£ŗ£Ø1£©Ńõ»Æ»¹Ō·“Ó¦4FeS2+11O2$\frac{\underline{\;øßĪĀ\;}}{\;}$8SO2+2Fe2O3ÖŠ£¬»ÆŗĻ¼ŪÉżøßµÄFe”¢SŌŖĖŲŌŚ·“Ó¦ÖŠ±»Ńõ»Æ£¬øĆ·“Ӧɜ³É8molµÄ¶žŃõ»ÆĮņ£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ44mol£¬ĖłŅŌµ±øĆ·“Ó¦×ŖŅĘ5.50molµē×ÓŹ±£¬Éś³ÉµÄ¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæĪŖ1mol£¬ŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ22.4L£¬
¹Ź“š°øĪŖ£ŗS”¢Fe£» 22.4£»
£Ø2£©¢ŁŹµŃéŹŅæÉÓĆ70%µÄÅØĮņĖįŗĶŃĒĮņĖįÄĘ·“Ó¦ÖĘČ”¶žŃõ»ÆĮņ£¬ĪŖ¹ĢĢåÓėŅŗĢå·“Ó¦²»¼ÓČČ×°ÖĆ£¬ÄÜæŲÖĘ·“Ó¦ĖŁ¶Č£¬ĄūÓĆ·ÖŅŗĀ©¶·æŲÖĘŅŗĢåµÄ¼ÓČė£¬ÓŠa”¢d·ūŗĻ£¬
¹Ź“š°øĪŖ£ŗa”¢d£»
¢ŚÓÉĮņŹŲŗćæÉµĆ£ŗNa2SO3”«SO2£¬Ņņ“ĖŠč³ĘČ”ŃĒĮņĖįÄʵÄÖŹĮæĪŖ£ŗm£ØNa2SO3£©=126g•mol-1”Į$\frac{3.36L}{22.4L/mol}$=18.9g£»
Éčƻӊ±äÖŹµÄŃĒĮņĖįÄĘĪŖ100g£¬ŌņÓŠ25.2gŃĒĮņĖįÄʱ»Ńõ»Æ³ÉĮņĖįÄĘ£¬25.2gŃĒĮņĖįŃõ»ÆĪŖĮņĖįÄĘŗóÖŹĮæ±äĪŖ£ŗ25.2g”Į$\frac{142}{126}$=28.4g£¬ŌņÓŠ25.2%ŃĒĮņĖįÄʱ»Ńõ»ÆĪŖĮņĖįÄʵÄѳʷ֊ŃĒĮņĖįÄʵÄÖŹĮæ·ÖŹżĪŖ$\frac{100g-25.2g}{100g-25.2g+28.4g}$”Į100%”Ö72.5%£¬
Ņņ“Ė³ĘČ”±äÖŹŗóѳʷµÄÖŹĮæÓ¦ĪŖ$\frac{18.9g}{72.5%}$”Ö26.1g£¬
¹Ź“š°øĪŖ£ŗ26.1£»
£Ø3£©¢Ł¶žŃõ»ÆĮņ¾ßÓŠŃõ»ÆŠŌ£¬æÉŅŌŗĶ×īµĶ¼ŪµÄĮņ»ÆÄĘ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬Éś³Éµ»ĘÉ«µÄ³ĮµķS£¬ĖłŅŌÄÜĖµĆ÷¶žŃõ»ÆĮņ¾ßÓŠŃõ»ÆŠŌµÄŹµŃéĻÖĻóĪŖaŹŌ¹ÜÖŠÓŠµ»ĘÉ«³ĮµķÉś³É£¬
¹Ź“š°øĪŖ£ŗaŹŌ¹ÜÖŠÓŠµ»ĘÉ«³ĮµķÉś³É£»
¢ŚĀČĖ®ÖŠŗ¬ÓŠĀČĘų£¬ĀČĖ®ÖŠ»¹ŗ¬ÓŠ“ĪĀČĖį”¢HCl£¬ĀČĘųŗĶ“ĪĀČĖį¾ßÓŠĒæŃõ»ÆŠŌ£¬
·½°øI£ŗĻņµŚŅ»·ŻČÜŅŗ¼ÓČėĘ·ŗģČÜŅŗ£¬ŗģÉ«ĶŹČ„£¬æÉŅŌŹĒĀČĖ®ÖŠŗ¬ÓŠµÄĘư׊ŌĪļÖŹ“ĪĀČĖįĘšµÄ×÷ÓĆ£»
·½°ø¢ņ£ŗĻņµŚ¶ž·ŻČÜŅŗ¼ÓČėBaCl2ČÜŅŗ£¬²śÉś°×É«³Įµķ£¬Ö¤Ć÷ČÜŅŗÖŠŗ¬ĮņĖįøłĄė×Ó£¬ŹĒ¶žŃõ»ÆĮņŌŚĖįŠŌ»·¾³ĻĀ±»ĀČĖ®Ńõ»ÆÉś³ÉµÄ£¬¼“SO2+Cl2+2H2O=4H++SO42-+2Cl-£¬SŌŖĖŲµÄ»ÆŗĻ¼ŪÉżøߣ¬ĢåĻÖ¶žŃõ»ÆĮņµÄ»¹ŌŠŌ£¬ŌņŹµŃéÉč¼ĘŗĻĄķ£¬
·½°ø¢ó£ŗĻņµŚČż·ŻČÜŅŗÖŠ¼ÓČėAgNO3ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£¬æÉÄÜŹĒĀČĖ®ÖŠµÄĀČĄė×Ó²śÉśµÄ×÷ÓĆ£¬
¹Ź“š°øĪŖ£ŗII£»Cl2+SO2+2H2O=4H++2Cl-+SO42-£®
µćĘĄ ±¾Ģā漲鶞Ńõ»ÆĮņµÄŠŌÖŹ£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆ¼ĘĖćÄÜĮ¦µÄ漲飬¶žŃõ»ÆĮņ¾ßÓŠŃõ»ÆŠŌ”¢»¹ŌŠŌ”¢Ęư׊Ō£¬×¢ŅāøĆŹµŃéµÄÄæµÄ£¬ÄÜ“Ó»ÆŗĻ¼Ū±ä»ÆÉĻĄ“·ÖĪö½ā“š£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH3OHµÄČ¼ÉÕČČĪŖ192.9 kJ/mol | |
| B£® | CH3OH×Ŗ±ä³ÉH2µÄ¹ż³Ģ²»Ņ»¶ØŅŖĪüŹÕÄÜĮæ | |
| C£® | øł¾Ż¢Ł¢ŚĶĘÖŖ·“Ó¦£ŗH2O£Øg£©ØTH2£Øg£©+$\frac{1}{2}$O2£Øg£©”÷H=+241.9 kJ/mol | |
| D£® | øł¾Ż¢ŚĶĘÖŖ·“Ó¦£ŗCH3OH£Øl£©+$\frac{1}{2}$O2£Øg£©ØTCO2£Øg£©+2H2£Øg£©µÄ”÷H£¾-192.9 kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ńõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĪļÖŹµÄĮæ±ČĪŖ8£ŗ3 | |
| B£® | ±»»¹ŌµÄHNO3ŗĶĘšĖįŠŌ×÷ÓƵÄHNO3µÄĪļÖŹµÄĮæµÄ±ČĪŖ2£ŗ3 | |
| C£® | Éś³É1molNOĘųĢå×ŖŅʵĵē×ÓŹżĪŖ3NA | |
| D£® | øĆ·“Ó¦ÖŠCu£ØNO3£©2 ĪŖŃõ»Æ²śĪļ£¬H2OĪŖ»¹Ō²śĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | KOHČÜŅŗÓėAlCl3ČÜŅŗ | B£® | AlCl3ČÜŅŗÓė°±Ė® | ||
| C£® | NaAlO2ČÜŅŗÓėŃĪĖį | D£® | NaHCO3ČÜŅŗÓėŃĪĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČČĪČ¶ØŠŌ£ŗNa2CO3£¾NaHCO3 | B£® | ĖįŠŌ£ŗH2CO3£¾H2SiO3 | ||
| C£® | ¼īŠŌ£ŗNaOH£¾LiOH | D£® | ČČĪČ¶ØŠŌ£ŗHF£¾HBr |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
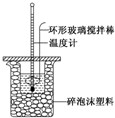 ijŹµŃ銔×éÓĆ0.50mol•L-1 NaOHČÜŅŗŗĶ0.50mol•L-1 ĮņĖįČÜŅŗ½ųŠŠ·“Ó¦ČČµÄ²ā¶Ø£¬ŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£®
ijŹµŃ銔×éÓĆ0.50mol•L-1 NaOHČÜŅŗŗĶ0.50mol•L-1 ĮņĖįČÜŅŗ½ųŠŠ·“Ó¦ČČµÄ²ā¶Ø£¬ŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£®| ĪĀ¶Č “ĪŹż | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ ¶Čt2/”ę | ĪĀ¶Č²ī Ę½¾łÖµ £Øt2-t1£©/”ę | ||
| H2SO4 | NaOH | Ę½¾łÖµ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com