
锂电池应用很广,某种锂离子电池,其正极材料可再生利用。其正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)写出“正极碱浸”中发生反应的化学方程式____________;
(2)“酸浸”一般在80℃下进行,写出该步骤中发生的主要氧化还原反应的化学方程式________________________;如果可用盐酸代替H2SO4和H2O2的混合溶液,可能发生反应的离子方程式___________________________;
(3)写出“沉钴”过程中发生反应的化学方程式______________________________;
(4)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出充电时正极的电极反应_____________________________________;
(5)在整个回收工艺中,可回收到的金属化合物有____________(填化学式);
(6)最近美国和韩国的科学家合作研究出新型锂—空气电池,他们的锂—空气电池在放电过程中产生稳定的晶状超氧化锂(LiO2),超氧化锂可以很容易地分解成锂和氧,从而具有更高的效率和更长的循环寿命。请写出该电池正极的电极反应 ____________。
科目:高中化学 来源:2015-2016学年吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列关于蛋白质的叙述中不正确的是( )
A.向蛋白质溶液中加饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解。
B.蛋白质溶液中蛋白质分子能通过滤纸,但不能通过半透膜。
C.浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质和浓硝酸发生颜色反应。
D.重金属盐能使蛋白质变性,吞服钡餐不会引起中毒。
查看答案和解析>>
科目:高中化学 来源:2016届青海省高三下高考冲刺一理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质]
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式______,它位于周期表______区。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为_______;1 mol C60分子中σ键的数目为_____个。

(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As____Ga(填“>”、“<”或“=”)。
②SeO2分子的空间构型为________。
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4 NH3 Cu NF3+3 NH4F,该反应中NH3的沸点 (填“>”、“<”或“=”)HF的沸点,NH4F固体属于 晶体。往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________ _______ 。图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:填空题
乙醇、甲醚是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) △H=-256.1kJ•mol-1。
CH3CH2OH(g)+H2O(g) △H=-256.1kJ•mol-1。
已知:H2O(l)=H2O(g)△ H=+44kJ•mol-1 CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ•mol-1
CO2(g)+H2(g) △H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l) △H=__________________kJ•mol-1
CH3CH2OH(g)+3H2O(l) △H=__________________kJ•mol-1
(2)把2molH2和1molCO通入1L的反应器中,一定条件下发生反应:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
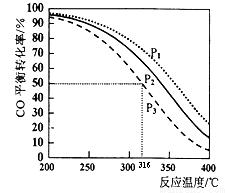
①以下能说明2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)达平衡状态的是___________
CH3OCH3(g)+H2O(g)达平衡状态的是___________
A.密度不再变化
B.CH3CH2OH蒸汽的体积分数不再变化
C.c(CO)/c(H2)不变
D.[c(CH3OCH3)•c(H2O)]/[c(CO)•c(H2)]不变
②图中的压强大小为: ,△H___________0(填“>”“<”或“=”),若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时反应的v(正)______v(逆)(填“>”“<”或“=”)。
③P3和316℃时反应的平衡常数________________
(3)汽车使用乙醇汽油并不能更加有效减少NOx的排放,气缸中生成NO的反应为:
N2(g)+O2(g) 2NO(g) △H>0
2NO(g) △H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是_________________
②汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池负极的电极反应式为__________________。用该电池为Pb+PbO2+2H2SO4 2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:选择题
化学与生活、能源、环境等密切相关。下列描述错误的是
A.医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75%
B.“雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C.用CO2合成可降解的聚碳酸酯塑料,可以减少“白色污染”
D.氮化硅陶瓷是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川一中高三三模理综化学试卷(解析版) 题型:选择题
下列有关说法中正确的是
A.某温度时的混合溶液中c(H+)= mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C.已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂。目前主要的合成方法有电解法、高温固相法等。
(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:
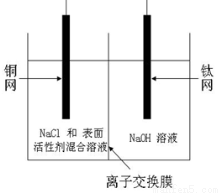
该电池的阳极反应方程式为 离子交换膜为_______(填阳或阴)离子交换膜,铜网应连接电源的_____极。
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O。
已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H = -846.3 kJ/mol
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157 kJ/mol
则该反应的热化学方程式是:__________。
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g)  2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2 T1(填“﹥”“﹤”或“﹦”),原因是___________________。
②实验①前20 min的平均反应速率 v(O2)=
③比较不同方法制得的Cu2O的催化效果应选用__________组实验,原因是___________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式为
A.向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++ =Fe3++NO2↑+H2O
=Fe3++NO2↑+H2O
B.向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O =Mg(OH)2↓+2Na+
C.向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D.向0.1mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应式为:CH4+10OH--8e-═CO32-+7H2O,下列叙述正确的是( )
A.通入甲烷的一极为正极
B.通入氧气的一极发生氧化反应
C.该电池工作时,溶液中的阴离子向正极移动
D. 该电池总反应为CH4+2O2+2OH-=CO32-+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com