
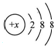 其中:
其中:分析 (1)某电中性粒子,一般不和其他元素的原子反应,则x=18;
(2)加入AgNO3溶液时会出现白色浑浊,应生成AgCl,x=17;
(3)粒子所对应元素的一种氧化物是导致“酸雨”的主要物质,为二氧化硫,x=16.
解答 解:(1)电中性微粒化学性质稳定,是具有稳定结构原子,质子数等于核外电子数为18,该粒子为氩,故答案为:氩;
(2)因白色浑浊是氯化银,所以该粒子是氯离子,故答案为:Cl-;
(3)粒子所对应元素的一种氧化物是导致“酸雨”的主要物质,为二氧化硫,x=16,为S2-,故答案为:S2-.
点评 本题考查核原子结构与元素性质,题目难度中等,注意阴离子中质子数=核外电子数-电荷数,阳离子的质子数=核外电子数+电荷数,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | KClO3在反应中发生还原反应 | |
| C. | 生成5.6LCO2,转移的电子数目为0.25NA | |
| D. | 24.5g KClO3参加反应,转移电子物质的量为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
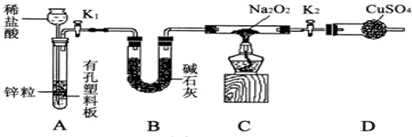 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.
钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Mg2+ | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Li>Na>K | B. | 还原性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子半径:Na<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
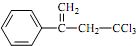 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法正确的是( )| A. | 属于卤代烃,不能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与 3molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液,若溶液变成血红色,则一定有Fe3+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
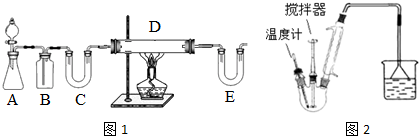
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| B. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5 平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com