
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
分析 电解水的方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阳极得到氧气,阴极得到H2、D2,由方程式知:氢气和氧气的体积之比为2:1,进而计算H2、D2的总物质的量、总质量,列方程计算各自物质的量,进而计算H原子和D原子个数之比.
解答 解:电解水的方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阳极得到氧气,阴极得到H2、D2,由方程式知:氢气和氧气的体积之比为2:1,故H2、D2的总体积为33.6L×$\frac{2}{3}$=22.4L,物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,氧气的体积为33.6L-22.4L=11.2L,氧气的质量=$\frac{11.2L}{22.4L/mol}$×32g/mol=16g,则H2、D2的总质量为18.5g-16g=2.5g,
设H2、D2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=1}\\{2x+4y=2.5}\end{array}\right.$
解得x=0.75、y=0.25
故混合气体中H原子和D原子个数之比为0.75mol:0.25mol=3:1,故选C.
点评 本题以电解原理为载体,考查了混合物有关计算、物质的量的有关计算,难度不大,可以计算氢气的平均摩尔质量,结合十字相乘法解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠可用作食品添加剂 | B. | 过氧化钠可用作潜水艇供氧剂 | ||
| C. | 铝制容器可以贮运稀硝酸 | D. | 氧化铁可用作外墙涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
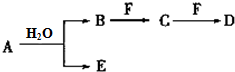 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题: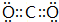 ;D中所含化学键的类型离子键和共价键.
;D中所含化学键的类型离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | LiH、LiD、LiT的摩尔质量之比为8:9:10 | |
| C. | 两原子如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2、SO3、P4和C6H6都是非极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 在电中性晶体中只要含有阳离子,则一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④ | B. | ③ | C. | ①② | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com