
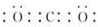 .
. .
. 分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D与B属于同一族元素,则D为S元素,据此进行解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D与B属于同一族元素,则D为S元素,
(1)根据上面的分析可知,A为C,B为O,C为Na;D为S元素,其质子数=中子数=16,则其质量数为32,该原子可以表示为:1632S,
故答案为:C; O; Na; 1632S;
(2)AB2为CO2,二氧化碳为共价化合物,分子中含有两个碳氧双键,其电子式为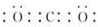 ,
,
故答案为: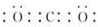 ;
;
(3)E为过氧化钠,过氧化钠为离子化合物,用电子式表示Na、O形成过氧化钠的过程为: ,
,
故答案为: .
.
点评 本题考查了位置结构与性质关系的应用,题目难度不大,推断元素为解答关键,侧重常见化学用语的表示方法考查,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
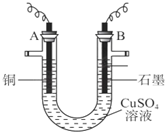
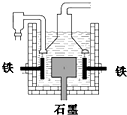 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不相同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
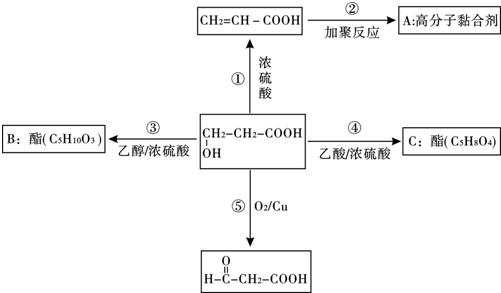
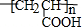 ,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.
,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| C. | 1 mol-CH3 含有9 mol 电子 | |
| D. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 100 g硫酸溶液的物质的量浓度为18.4 mol•L-1,用水稀释到物质的量浓度为9.2 mol•L-1,需要水100 g | |
| C. | 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀 | |
| D. | 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 减少重金属、农药和难分解有机物的排放 | |
| C. | 加大石油、煤炭的开采速度,增加化石燃料的供应量 | |
| D. | 开发新能源和新致冷剂,减少CO2和氟氯烃等物质的大量排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com