
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
(1)1×10-14 (2)H2SO4 (3)NH4Cl (4)1×10-9 mol/L 1×10-5 mol/L (5)> 减小
【解析】(1)在室温时,水的离子积常数为1×10-14。
(2)加水稀释后H2SO4溶液中H+直接稀释,而NH4Cl溶液中NH4++H2O NH3·H2O+H+平衡右移,溶液中H+被稀释同时,又增加,故pH较大的是H2SO4溶液。
NH3·H2O+H+平衡右移,溶液中H+被稀释同时,又增加,故pH较大的是H2SO4溶液。
(3)升高温度促进NH4+的水解,H+浓度增大,故pH较小的是NH4Cl溶液。
(4)由水电离的c(H+)等于由水电离出的c(OH-),故H2SO4溶液中由水电离出的c(H+)= =10-9 mol/L,NH4Cl溶液中水电离出的c(H+)=1×10-5 mol/L。
=10-9 mol/L,NH4Cl溶液中水电离出的c(H+)=1×10-5 mol/L。
(5)加水稀释后使平衡NH4++H2O NH3·H2O+H+右移,故c(H+)>10-6 mol/L,
NH3·H2O+H+右移,故c(H+)>10-6 mol/L, 减小。
减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学苏教版总复习10-1化学实验常用仪器和基本操作练习卷(解析版) 题型:选择题
下列实验装置(固定装置略去)和操作正确的是( )

A B C D
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
环保型燃料—丙烷(C3H8)曾用于北京奥运会“祥云”火炬燃料,下列有关烷烃的说法不正确的是( )
A.丙烷分子中三个碳原子共平面
B.丁烷的一氯代物共有4种
C.正丁烷的4个碳原子在一直线上
D.CnH2n+2的烃中含有3n+1个共价键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是( )
A.同温度下,CuS的溶解度大于ZnS的溶解度
B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1
C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生
D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.溶度积大的化合物溶解度一定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,又达到平衡时,AgCl的溶解度不变,溶度积也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl是弱电解质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
为了使FeCl3溶液中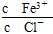 增大,可加入的物质是( )
增大,可加入的物质是( )
A.适量的HCl气体 B.适量的硫酸氢钠
C.适量的NaOH固体 D.适量的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3— +H2O CO32—+H3O+
CO32—+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③ C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com