
【题目】环与环之间共用两个或多个碳原子的多环烷烃称为桥环烷烃,其中二环[1.1.0]丁烷 (![]() )是其中一种。下列关于该化合物的说法正确的是
)是其中一种。下列关于该化合物的说法正确的是
A. 与C3H4是同系物
B. 一氯代物只有一种
C. 与环丁烯互为同分异构体
D. 所有碳原子可能都处于同一平面
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。


(1)写出下列仪器的名称:a._________,b.__________,c.___________。
(2)仪器a~e中,使用前必须检查是否漏水的有_______________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由______口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是________________。
②根据计算得知,需用托盘天平称量的NaOH的质量为____g 。
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若未等溶液冷却就转移至容量瓶并定容_________;容量瓶用蒸馏水洗涤后残留有少量的水________;若定容时俯视刻度线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得:
I.制备碳酸亚铁
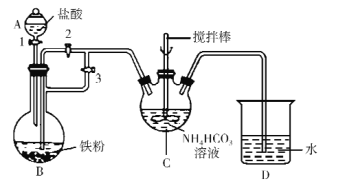
(1)仪器C的名称是_____。
(2)利用如图所示装置进行实验。首先关闭活塞2,打开活塞1、3,目的是____;关闭活塞1,反应一段时间后,关闭活塞____,打开活塞______,观察到B中溶液进入到C中,C中产生沉淀和气体,写出制备FeCO3的离子方程式____。
(3)装置D的作用是____。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是_____。
(5)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是_________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00mL,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示。
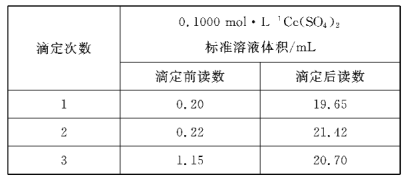
则产品中乳酸亚铁晶体的纯度为___%(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒和硫是同一主族元素,二氧化硒(SeO2))是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1 :1,写出Se和浓HNO3的反应方程式_______________ 。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO42-+4H+,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①__SeO2+__KI+__HNO3―→__Se+__I2+__KNO3+__H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平方程式①,用单线桥标出电子转移的方向和数目。__________________
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
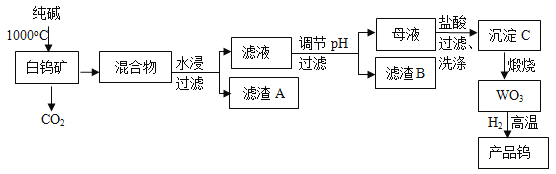
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、K、L六种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y原子核外电子有6种不同的运动状态;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K的+1价阳离子的核外有3层电子且各层均处于全满状态;L位于ds区,它的基态原子的N层上只有2个电子。
请回答下列问题:(答题时,X、Y、Z、W、K、L用所对应的元素符号表示)
(1)ZX5为离子化合物,写出它的电子式_________________。
(2) K的基态原子的电子排布式是______________________。
(3) Y、Z、W元素的第一电离能由大到小的顺序是__________________。
(4)第一电离能I1(L)__I1(K)(填“大于”或“小于”),原因是________________
(5)Y2X4是石油炼制的重要产物之一, 1mol Y2X4分子中含σ键为______mol;
(6)肼(Z2H4)可用作火箭燃料,其原理是:Z2O4(l)+2Z2H4(l)=3Z2(g)+4H2O(g),若反应中有4mol Z-H键断裂,则形成的π键有_________mol.
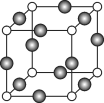
(7)Z、K两元素形成的某化合物的晶胞结构如图所示,则Z原子的配位数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示:
(1)根据下列几种粒子的结构示意图,回答问题:

①写出B微粒的符号_________;
②若A微粒的中子数为10,写出表示A微粒的组成符号________;
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:_________;
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热____________;
②工业上制备氯气____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含Cr2072-的废水,探究不同因素对含Cr2072-废水处理的影响,结果如表所示(Cr2072-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(S04)3 | 否 | 否 | 否 | ||
是否加入H2S04 | 否 | 加入lmL | 加入lmL | 加入lmL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2072-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2072-的机理 |
A. 实验ii与实验i对比,其他条件不变,增加c(H+)有利于Cr2072-的去除
B. 实验iii与实验ii对比,其他条件不变,增加c(Fe3+)有利于Cr2072-的去除
C. 实验iv中循环利用提高了Cr2072-的去除率
D. 若实验iv中去除O.OlmolCr2072-电路中共转移0.06mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com