
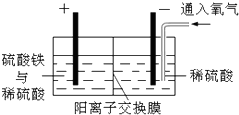
 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:分析 (1)硫化氢有毒,直接排放会污染空气,硫化氢具有还原性,硫酸铁具有氧化性能氧化硫化氢生成硫单质;
(2)首先氢离子放电生成氢气,反应一段时间,铜离子放电生成铜,再通入氧气的条件下Cu、氧气、硫酸反应生成硫酸铜;
(3)有机相和水相不互溶,分离有机相和水相通常利用分液的方法,使用的仪器为分液漏斗;
(4)增大氢离子浓度,根据平衡移动原理分析;
(5)电解uSO4溶液,发生反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,200mL 0.5mol/L的CuSO4溶液中n(CuSO4)=0.2L×0.5mol/L=0.1mol,生成铜3.2g,物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,故生成H2SO40.1mol,溶液中CuSO4为0.1mol-0.05mol=0.05mol,电解后的溶液为CuSO4、H2SO4混合溶液,溶液中存在硫酸的电离、铜离子水解、水的电离等,据此判断.
解答 解:(1)由发生的反应可知,Fe3+氧化吸收硫化氢气体,发生2Fe3++H2S=2Fe2++S↓,防止环境污染,
故答案为:吸收硫化氢气体,防止环境污染;
(2)首先氢离子放电生成氢气,反应一段时间,铜离子放电生成铜,再通入氧气的条件下Cu、氧气、硫酸反应生成硫酸铜,发生的反应依次为:2H++2 e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O,析出红色固体的反应方程式Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
(3)有机相和水相不互溶,分离有机相和水相通常利用分液的方法,使用的仪器为分液漏斗,
故答案为:分液漏斗;
(4)向有机相中加入一定浓度的硫酸,增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生,
故答案为:增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生;
(5)电解uSO4溶液,发生反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,200mL 0.5mol/L的CuSO4溶液中n(CuSO4)=0.2L×0.5mol/L=0.1mol,生成铜3.2g,物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,故生成H2SO40.05mol,溶液中CuSO4为0.1mol-0.05mol=0.05mol,电解后的溶液为CuSO4、H2SO4混合溶液,溶液呈酸性,溶液中铜离子水解、水发生电离,故n(H+)>0.05mol×2=0.1mol,n(SO42-)=0.1mol,n(Cu2+)<0.05mol,溶液中氢氧根浓度很小,故c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
点评 本题考查电解原理、对工艺原理的理解、常用化学用语、离子浓度比较等,题目综合性较大,是对所学知识的综合考查,需要学生具有知识的基础与分析、解决问题的能力,难度中等,(5)中注意根据物质的量判断离子大小.


科目:高中化学 来源: 题型:选择题
| A. | 钠、钾着火时,不能用泡沫灭火器灭火 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| D. | 在汽车尾气系统中装催化转化器,可降低尾气中CO、NOx等的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
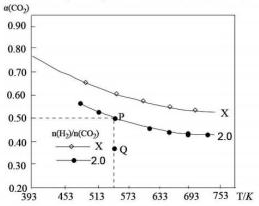 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 若起始时,CO2、H2、浓度分分别为0.5mol/L和1.0mol/L,则可得P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.7% | B. | 50% | C. | 66.7% | D. | 83% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
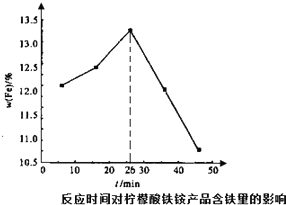 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
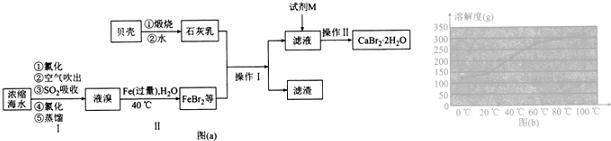
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
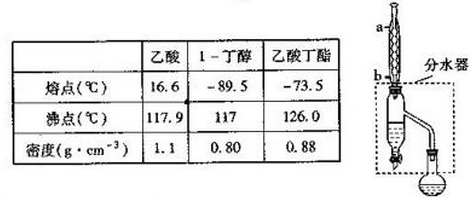

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com