
| A. | 用明矾净水 | B. | 用“84消毒液”消毒 | ||
| C. | 胶体的提纯 | D. | 用小苏打治疗胃酸过多 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5s | B. | 1s | C. | 30s | D. | 60s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有(3) | B. | 只有(2) | C. | (2)和(3) | D. | 都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
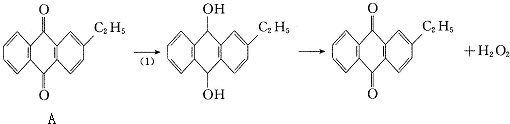
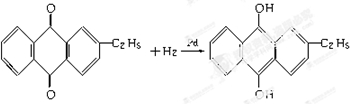 .
.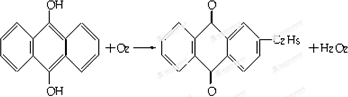 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2不能与CaCl2溶液反应,则SO2也不能与CaCl2溶液反应 | |
| B. | 金属钠着火不能用CO2扑灭,则金属钾着火也不能用CO2扑灭 | |
| C. | Al2O3可溶于强酸和强碱,则BeO也可溶于强酸和强碱 | |
| D. | Mg (OH)2难溶于水,则Ca(OH)2也难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的硝酸的物质的量为0.4mol | |
| B. | 加入合金的质量可能为9.6g | |
| C. | 沉淀完全时消耗NaOH溶液体积为150mL | |
| D. | 溶解合金时产生NO气体体积0.224L(以标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都引起σ增大 | |
| B. | 都引起σ减小 | |
| C. | 充入NO2引起σ增大,充入N2O4引起σ减小 | |
| D. | 充入NO2引起σ减小,充入N2O4引起σ增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com