
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
(1)13 (2)< NH4++H2O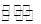 NH3·H2O+H+ (3)C (4)<
NH3·H2O+H+ (3)C (4)<
解析试题分析:(1)求溶液的pH,就是求溶液中氢离子浓度的负对数,25 ℃时,0.1 mol·L-1NaOH溶液的氢氧根离子浓度为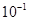 ,那么氢离子浓度就为
,那么氢离子浓度就为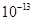 ,所以其pH=13 (2)氯化铵是强酸弱碱盐,水解显酸性,因此其pH<7,可以用以下方程式表示: NH4++H2O
,所以其pH=13 (2)氯化铵是强酸弱碱盐,水解显酸性,因此其pH<7,可以用以下方程式表示: NH4++H2O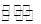 NH3·H2O+H+ (3)上述两种溶液等体积混合后,得到等物质的量的氨水和氯化钠,因此有C;(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=
NH3·H2O+H+ (3)上述两种溶液等体积混合后,得到等物质的量的氨水和氯化钠,因此有C;(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=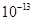 ;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=
;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=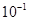 ,,则C1<C2。
,,则C1<C2。
考点:考查溶液的酸碱性。


科目:高中化学 来源: 题型:填空题
(1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_____________________。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中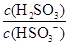 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某温度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为________。
(4)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
①阴极的电极反应式为________________________;
②产品室中反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA。
(1)此一元弱酸的物质的量浓度为 ;
(2)此条件下该一元弱酸的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)如图是甲烷燃料电池原理示意图,回答下列问题: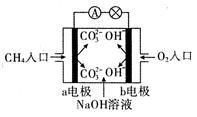
①电池的负极是 (填“a”或“b” )极,该极的电极反应式是 。
② 电池工作一段时间后电解质溶液的pH (填“增大”、“减小”或“不变”)。
(2)利用甲烷燃料电池及下图所示的装置完成电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气的氧化性。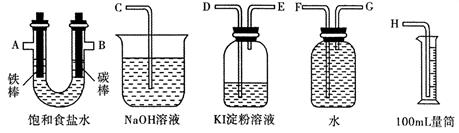
①设计上述实验装置时,各接口的正确连接顺序为: 接 、 接 A 、 B 接 、 接 。
②实验中,在盛有 KI 淀粉溶液的容器中发生反应的离子方程式为 。
③已知饱和食盐水50mL,某时刻测得 H2体积为56mL (标准状况),此时溶液 pH 约为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
| 实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.54 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.36 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下,将NH3·H2O与盐酸等体积混合,实验数据如下:
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
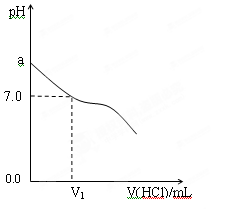
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有下列物质①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤Ba(OH)2溶液;⑥熔融NaCl;⑦稀氨水;⑧BaSO4;⑨H2O
(1)属于强电解质的是 (填序号) 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com