
| A. | 常温常压下,14 g丙烯和丁烯的混合气体含有的原子数为6NA | |
| B. | 25℃,pH=1的1 L H2SO4溶液含有的H+数目为0.2NA | |
| C. | 1 mol Fe与一定量的HNO3反应,转移的电子数目一定为3NA | |
| D. | 标准状况下,22.4 L NO和O2的混合气体中所含原子数为2NA |
分析 A、丙烯和丁烯的最简式均为CH2;
B、pH=1的溶液中氢离子浓度为0.1mol/L;
C、铁和硝酸反应,最后可能变为+3价,也可能变为+2价;
D、求出混合物的物质的量,然后根据NO和氧气均为双原子分子来分析.
解答 解:A、若14 g都是丙烯,n=0.5 mol,原子数为0.5×6=3 mol,若14g都是丁烯,含有原子也是3 mol,二者共14 g,含有原子也是3 mol,故无论两者的比例如何,含有的原子数均为3NA个,故A错误;
B、pH=1则c(H+)=0.1 mol?L-1,n(H+)=0.1 mol/L×1 L=0.1 mol,H+数目是0.1NA,故B错误;
C、Fe可能生成Fe2+也可能生成Fe3+,还有可能是二者混合物,故1mol铁反应后转移的电子数不一定是3NA个,故C错误;
D、在标准状况下22.4 L气体的物质的量为1 mol,NO和O2都是双原子分子,则含原子一共2 mol,虽然NO和O2反应,但原子守恒,故原子数目不变,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
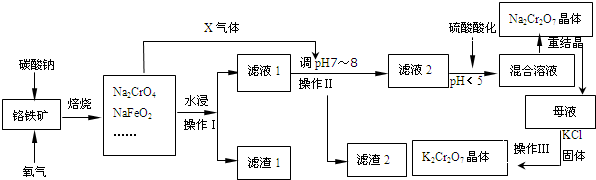
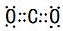 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-?CH3COO-+H2O | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | S2-+H2O?HS-+OH- | D. | NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: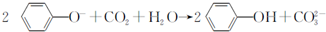 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气前要检验纯度,以免发生爆炸 | |
| B. | 不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 | |
| C. | CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2 | |
| D. | 在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
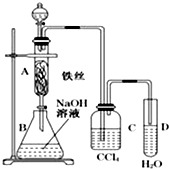 某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图所示装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
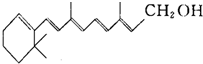 维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )
维生素A的结构简式如图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来.关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H28O | |
| B. | 维生素A是一种易溶于水的醇 | |
| C. | 维生素A能与酸发生酯化反应 | |
| D. | 1 mol维生素A在催化剂作用下最多可与7 mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com