
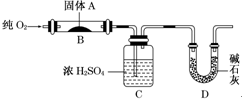
 实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12
实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出)H:1 O:16 C:12| 9.99g |
| 18g/mol |
| 26.4g |
| 44g/mol |
| 8.79g |
| 16g/mol |
| 点燃 |
| 点燃 |
| 催化剂 |
| 催化剂 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯可以催熟植物的果实 |
| B、乙烯可以与水发生加成反应 |
| C、乙烯分子的空间构型是正四面体 |
| D、使用溴水或KMnO4 溶液,都可以鉴别乙烯和乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
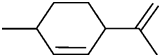
| A、分子式为C10H16 |
| B、常温下呈固态,比水重 |
| C、其一氯代物有8种 |
| D、能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=4.75、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、0.01mol?L-1 NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| D、室温下,向0.01mol?L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率提高 |
| D、C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质占空气体积的1/5 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com