
分析 原电池中阳离子向正极移动,活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;电解硫酸时,作一段时间后锌片的质量减少了6.5g,物质的量为:$\frac{6.5g}{65g/mol}$=0.1mol,所以转移电子的物质的量为0.2mol,生成氢气为0.1mol,所以标准状况下 2.24L,由此解答.
解答 解:原电池中阳离子向正极移动,活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;电解硫酸时,作一段时间后锌片的质量减少了6.5g,物质的量为:$\frac{6.5g}{65g/mol}$=0.1mol,所以转移电子的物质的量为0.2mol,生成氢气为0.1mol,所以标准状况下 2.24L,
故答案为:正极; Zn-2e-=Zn2+;2.24.
点评 本题考查原电池的工作原理,侧重于基础知识的考查,题目难度不大,注意两极电极反应转移的电子数目相等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1L pH=1的硫酸溶液中,含有H+的数目为0.1NA | |
| B. | 22.4L HCl和22.4L DCl中 所含质子数均为18NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 1 mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使溴水褪色的物质一定能和溴水发生加成反应 | |
| B. | 天然蛋白质水解的最终产物是多种α-氨基酸 | |
| C. | 能发生银镜反应的物质都是醛 | |
| D. | 棉花和蚕丝的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,平衡常数增大 | |
| B. | 当v(CO2)正=$\frac{1}{2}$v(N2)逆时,说明反应达到平衡状态 | |
| C. | 增加CO的物质的量浓度,NO的转化率增大 | |
| D. | 增大压强,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
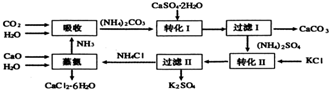
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

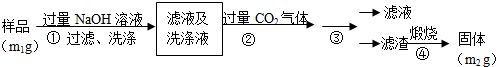
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:V乙≤10V甲 | |
| B. | 若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com