
分析 (1)S的原子结构为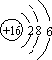 ,电子层数等于周期数,最外层电子数等于族序数;
,电子层数等于周期数,最外层电子数等于族序数;
(2)硒(34Se)与硫在元素周期表中位于同一主族,性质相似,非金属性S>Se;
(3)①2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
②H2O(g)=H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
由盖斯定律可知,①-②×2-③×2得到2SO2(g)+O2(g)?2SO3(g),以此计算△H;
(4)氯气具有强氧化性,SO32-中+4价的硫具有还原性,氯气与SO32-会发生氧化还原反应;溶液显碱性时能与溴水反应,不能确定溴水与SO32-会发生氧化还原反应.
解答 解:(1)S的原子结构为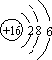 ,则S位于第三周期ⅥA族,
,则S位于第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)a.水中含氢键,沸点最高,则沸点:H2O>H2Se>H2S,故a错误;
b.非金属性S>Se,则H2Se比H2S稳定性弱,故b错误;
c.同主族,原子序数大的原子半径大,则Se的原子半径比S原子大,故c正确;
d.SeO2和SO2含有共价键,化学键类型相同,故d正确;
故答案为:c d;
(3)(3)①2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
②H2O(g)=H2O(l)△H2=-44kJ/mol
③SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
由盖斯定律可知,①-②×2-③×2得到2SO2(g)+O2(g)?2SO3(g),则△H=(-545kJ/mol)-(-44kJ/mol)×2-(-130kJ/mol)×2=-197kJ/mol,
故答案为:-197;
(4)①吸收SO2后的碱性溶液还可用于Cl2的尾气处理,亚硫酸钠与氯气发生氧化还原反应生成硫酸钠和盐酸,则吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-,故答案为:SO42-、Cl-;
②滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色,
故答案为:NaOH溶液能跟溴单质反应,使溶液呈无色.
点评 本题考查较综合,涉及元素在周期表中的位置、盖斯定律计算、化学键及同族元素的性质等,综合性较强,侧重分析与应用能力及化学反应原理的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将一块钠放在燃烧匙中加热,燃烧后得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
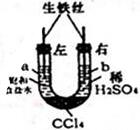 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量CO32-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操 作 | 现 象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A. | 可能含有的离子是①③⑥ | B. | 肯定没有的离子只有② | ||
| C. | 不能确定的离子只有⑤ | D. | 肯定含有的离子是①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应可表示为2SO2+O2+2H2O$\stackrel{NO_{2}}{→}$2H2SO4 | |
| B. | 还可能发生的反应有4NO2+O2+2H2O→4HNO3 | |
| C. | NO2由反应N2+O2$\stackrel{放电}{→}$NO2生成 | |
| D. | 还可能发生的反应有4NO+3O2+2H2O→4HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 在共价化合物中一定含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com