
| A. | 使用容量瓶前必须检查容量瓶是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 称好的固体试样需用纸条小心地送入容量瓶中 | |
| D. | 摇匀后发现凹液面下降,再加水至刻度线 |
分析 A.依据容量瓶构造及使用方法解答;
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗,导致溶质的物质的量偏大;
C.依据容量瓶使用方法和注意事项解答;
D.摇匀后发现凹液面下降,再加水至刻度线,导致溶液体积偏大.
解答 解:A.容量瓶带有瓶塞,使用过程中应上下颠倒,所以使用前必须检查是否漏水,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗,导致溶质的物质的量偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
D.摇匀后发现凹液面下降,再加水至刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏低,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和容量瓶使用方法及注意事项是解题关键,题目难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:填空题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H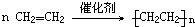 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
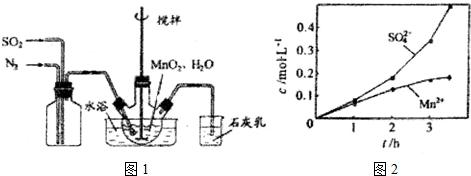
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL 50.0g | B. | 950mL 47.5g | C. | 950mL 30.4g | D. | 1000mL 32.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
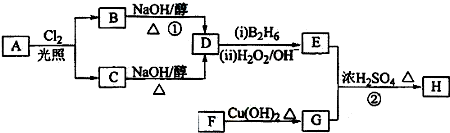
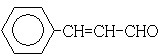 ;
;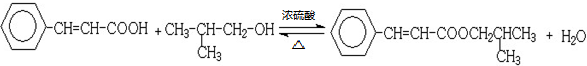 ;
;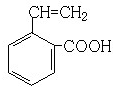 、
、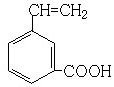 、
、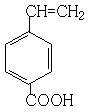 、
、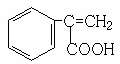 (其中任意两种).
(其中任意两种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com