
A.NaCl B.Na2O C.Na2CO3 D.NaHCO3
科目:高中化学 来源: 题型:
| 次数 | 滴定前(mL) | 滴定后(mL) |
| 1 | 0.40 | 21.10 |
| 2 | 0.10 |
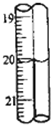 第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第四次阶段测试化学试卷(解析版) 题型:选择题
用标准氢氧化钠溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作会导致实验结果偏高的是
A.配制标准溶液的氢氧化钠中混有碳酸钠
B.滴定终点读数时,俯视滴定管的读数,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,没用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com