
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.金刚石>SiO2>NaCl>钠
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属卤化物是典型的离子晶体,它们的晶格能与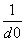 成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
| 晶格能/kJ·mol-1 | 离子半径/pm | |
| ① | LiF LiCl LiBr LiI 1 031 845 807 752 | Li+ Na+ K+ 60 95 133 |
| ② | NaF NaCl NaBr NaI 915777 740 693 | F- Cl- Br- I- 136 181 195 216 |
| ③ | KF KCl KBr KI 812 708 676 641 |
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.金属卤化物晶体中,晶格能越小,还原性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
参考表中物质的熔点,回答有关问题。
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.0 | -70.4 | -49.5 | -36.2 | -15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的__________有关,随着__________的增大,熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与________________有关,随着________________增大,________________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与__________有关,因为一般__________比__________的熔点高。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨晶体具有一些独特的性质,质地较柔软但熔点很高,还具有导电性,这主要是因为石墨晶体具有一种独特的结构,石墨晶体是( )
A.原子晶体 B.金属晶体
C.分子晶体 D.混合键型晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品是目前天然气转化利用的主要技术路线。请回答下列问题:
(1)Fe (CO)5中铁的化合价为0价,写出基态铁原子的电子排布式:_____________。
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为________和________(填化学式),CO分子的结构式可表示成__________。在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com