
| A、水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动 |
| B、浓度为5mol/L和0.5mol/L的两种FeCl3溶液,其它条件相同时,Fe3+的水解程度前者比后者低 |
| C、有50℃和20℃的相同浓度氯化铁溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D、为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸 |


科目:高中化学 来源: 题型:
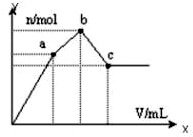 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、c点溶液呈碱性 |
| B、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| C、c点加入Ba(OH)2溶液的体积为200 mL |
| D、a点的溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量使用化肥农药,提高粮食产量 |
| B、禁止未经处理的工业废水和生活污水的任意排放 |
| C、积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 |
| D、大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.5 mol?L-1Ca(NO3)2 溶液中含有的 NO3-数目为0.5NA |
| B、5.6g Fe粉在足量的Cl2中完全燃烧转移的电子数目为0.2NA |
| C、在常温常压下,11.2 L氮气所含的原子数目为NA |
| D、17 g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中:c(H+)=[1000b+c(OH-)V]/V mol/L |
| B、t℃时,HA的溶解度:S=(100a/ρ)V g |
| C、物质的量浓度:c(HA)=(1000a/MV) mol/L |
| D、HA的质量分数:ω(HA)=(a/ρV)×100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com